[Il ruolo della stimolazione biofisica con I-ONE terapia nella medicina rigenerativa per la riparazione del danno cartilagineo]
Leo Massari MDa, Stefania Setti MScb
a Dipartimento di Scienze Biomedicali e Terapie Avanzate, Sezione di Ortopedia Clinica, Ospedale Sant’Anna, Università di Ferrara, Ferrara, Italia
b IGEA SpA, Clinical Biophysics, Carpi (MO), Italia
Journal of Sports Traumatology, Vol. 27, N° 3, 2010
I tentativi di riparazione della cartilagine articolare richiedono l’esistenza in sede di lesione di un tessuto ingegnerizzato in grado di promuovere la guarigione. Tuttavia, la presenza di citochine pro-infiammatorie nell’ambiente articolare in cui viene posto il tessuto ingegnerizzato influisce negativamente sulla qualità del risultato. In presenza di reazione infiammatoria secondaria all’atto chirurgico la possibilità di agire per via sistemica con i FANS è limitata, in quanto dipendente dalle ridotte capacità dei farmaci di diffondere nella sede di lesione.
Il controllo locale ed efficace dell’ambiente articolare si rivela fondamentale per il successo delle diverse tecniche di ingegneria tissutale: è questo il ruolo che assume la stimolazione biofisica nell’ambito clinico della medicina rigenerativaMEDICINA RIGENERATIVA
La medicina rigenerativa è un innovativo approccio terapeutico al trattamento dei danni tissutali secondari ad eventi acuti o cronici. Le tecniche di ingegneria tissutale mirano al ripristino delle funzioni del tessuto danneggiato tramite l’uso combinato di scaffolds, cellule e, più recentemente, di stimoli biofisici (1). L’obiettivo è offrire al paziente un sollievo dalla sintomatologia dolorosa, un più veloce ritorno ai precedenti livelli di attività sportiva e prevenire, o almeno ritardare, un’ulteriore degenerazione cartilaginea.
Lo studio di scaffolds biocompatibili, strutturalmente e meccanicamente stabili, capaci di sopportare stress meccanici e con alta potenzialità di esser colonizzati da cellule, è un chiaro esempio di ingegneria tissutale per la riparazione di difetti della cartilagine articolare (2). L’utilizzo di scaffolds ingegnerizzati permette di raggiungere solo parzialmente questo obiettivo; la funzionalità del tessuto riparato risulta spesso inferiore a quella del tessuto originario, la cartilagine ialina, se prodotta, è di frequente immatura e non perfettamente strutturata, per cui il tessuto riparato può risultare biomeccanicamente inadeguato a resistere alle sollecitazioni più comuni alle quali è sottoposta la cartilagine articolare. Inoltre, l’eventuale mancanza di integrazione tissutale all’interfaccia tra tessuto ospite e impianto genera un inevitabile fallimento del costrutto stesso (2, 3).
C’è quindi un’assoluta necessità di identificare tutte quelle procedure atte a migliorare lo sviluppo, l’utilizzo, l’integrazione e la sopravvivenza del tessuto ingegnerizzato.
FUNCTION TISSUE ENGINEERING ROAD MAP
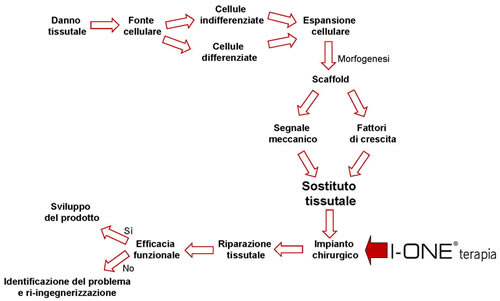
I membri della U.S. National Committee on Biomechanics (USNCB) hanno proposto una Road Map per la Functional Tissue Engineering (FTE) (4) (Figura 1) applicabile anche per la riparazione del tessuto cartilagineo danneggiato.
La Road Map mostra le fasi di sviluppo per preparare in vitro un idoneo tessuto ingegnerizzato costituito da un opportuno materiale di supporto e da un’adeguata popolazione cellulare.
Nella fase di preparazione in vitro del tessuto ingegnerizzato è necessario mantenere delle condizioni di coltura strettamente controllate per creare un ambiente favorevole sia alla colonizzazione del substrato, sia a mantenere il fenotipo cellulare differenziato che si desidera; a questo scopo risulta fondamentale la scelta dei fattori di crescita e la loro concentrazione nel terreno di coltura.
Questa struttura, una volta che il costrutto é impiantato, sarà poi colonizzata da cellule, differenziate o meno, atte a svolgere le funzioni proprie del tessuto originario. Il risultato clinico dipenderà dalla capacità del tessuto ingegnerizzato di integrarsi omogeneamente con il tessuto ricevente e di formare un tessuto funzionale.
Figura 1: Road Map per la Functional Tissue Engineering (FTE).
sollievo dalla sintomatologia dolorosa, un più veloce ritorno ai precedenti livelli di attività sportiva e prevenire, o almeno ritardare, un’ulteriore degenerazione cartilaginea.
I fattori che possono condizionare il successo di un intervento di ingegneria tissutale nella pratica clinica sono numerosi e non tutti sempre controllabili (5). Un ruolo fondamentale riveste l’ambiente locale, che è fortemente condizionato dalla manualità richiesta per il posizionamento dell’impianto e dal danno locale che l’atto chirurgico può provocare, tra cui una reazione infiammatoria difficilmente controllabile.
La presenza in ambiente articolare di citochine pro-infiammatorie, quali interleuchina-1β e fattore di necrosi tumorale-α, , risulterà dannosa per la popolazione cellulare trapiantata, poiché la presenza di infiammazione favorisce l’espressione di un fenotipo fibroblastico (6), con gravi conseguenze per la qualità del tessuto di riparazione, che tenderà verso la fibrocartilagine.
Inoltre, l’ambiente infiammatorio favorisce le attività cataboliche della cartilagine articolare con conseguente degradazione della matrice extracellulare. L’infiammazione favorisce il rilascio nel liquido sinoviale da parte dei sinoviociti di prosteoglandine E2 (PGE2) ad attività pro-apoptotica sui condrociti (7).
RUOLO DI I-ONE terapia
La letteratura internazionale ha dimostrato che il controllo locale dell’infiammazione è attuabile tramite l’impiego di stimoli fisici, in particolare l’utilizzo di campi elettromagnetici pulsati con specifiche grandezze fisiche: I-ONE terapia (IGEA, Carpi, Italy) (Figura 2) (8).
Figura 2
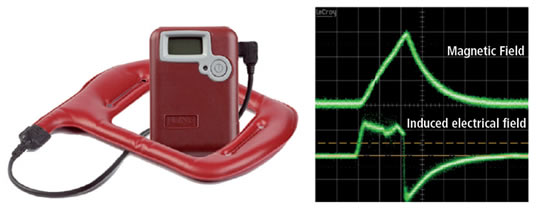
Figura 3
Il meccanismo d’azione di I-ONE terapia è l’azione agonista per il recettore adenosinico A2A che determina un importante effetto antinfiammatorio, antidegenerativo, condroprotettivo e un aumento delle attività anaboliche della cartilagine articolare (Figura 3) (9). Inoltre, è stato dimostrato che I-ONE terapia è in grado di inibire il rilascio delle PGE2 e di aumentare la sintesi di proteoglicani in sinergia con insulin like growth factor-1 (10, 11).
Studi in vitro e in vivo mostrano che I-ONE terapia controlla l’infiammazione, protegge la matrice extra-cartilaginea e favorisce le attività metaboliche dei condrociti; questi risultati hanno fornito un forte razionale all’utilizzo di I-ONE terapia in ambito clinico (9,11-13).
In due studi clinici, randomizzati, prospettici e in doppio cieco, in pazienti con lesioni cartilaginee trattati con microfratture in artroscopia e in pazienti sottoposti a ricostruzione del legamento crociato anteriore, è stato evidenziata una minor assunzione di farmaci antinfiammatori non steroidei e un tempo di recupero funzionale dimezzato nei pazienti trattati con I-ONE terapia (14, 15).
Inoltre, è stato dimostrato che un trattamento precoce dell’articolazione nell’immediato post-operatorio consente di mantenere un miglior recupero funzionale, in particolare una piena ripresa della attività sportiva, anche nel lungo periodo, a tre anni di follow-up (14).
CONCLUSIONI
Evidenze sperimentali e cliniche indicano che I-ONE terapia è in grado di inibire la risposta infiammatoria in modo rapido ed efficace, di prevenire e/o rallentare i fenomeni degenerativi che si accompagnano agli interventi chirurgici e, in ultima analisi, di favorire l’espressione del fenotipo condrocitario.
I-ONE terapia consente di trattare tutte le strutture articolari in modo omogeneo e tutta la cartilagine nella sua estensione e nel suo spessore, osso subcondrale compreso.
Queste osservazioni individuano nella Road Map per la FTE l’importante ruolo di I-ONE terapia nelle fasi immediatamente successive all’impianto al fine di generare un ambiente favorevole al processo riparativo (Figura 1).
Il trattamento locale ed efficace dell’articolazione mediante I-ONE terapia costituisce un’importante opzione terapeutica, che assume un notevole rilievo in una prospettiva di medicina rigenerativa e di ingegneria tessutale. I-ONE terapia è un trattamento di semplice utilizzo, privo di effetti collaterali e il suo impiego è ben accettato dai pazienti.
BIBLIOGRAFIA