Biodisponibilità e tollerabilità locale di un nuovo
antinfiammatorio topico contenente piroxicam 14 mg
formulato come cerotto medicato vs. una crema
contenente piroxicam 1%.
Alessandro Allegrini1, Loredana Nuzzo1, Daniele Pavone1, Mirco Zucchelli1, Andrea Tavella Scaringi1, Daniela Giangreco1, Marco Bucci1, Elena Toniato1, Andrea Mezzetti1, Stefano Martinotti1, Sergio Comuzio2
1Clinical Research Centre, Centre of Excellence on Aging, “G. D’Annunzio” University Foundation, Chieti, Italy. 2SpA Italiana Laboratori Bouty, Milan, Italy
Introduzione
Sebbene l’uso di Farmaci Antiinfiammatori Non Steroidei (FANS) sia ampiamente diffuso per il loro effetto analgesico duraturo e per il trattamento di stati infiammatori acuti e cronici, il loro utilizzo può essere associato con seri eventi avversi sistemici, tra cui, quelli di maggior riscontro clinico, sono di tipo gastrointestinale.
I FANS per uso topico sono stati studiati in passato proprio per evitare gli effetti indesiderati menzionati e, recentemente,
è stato sviluppato un nuovo cerotto medicato per uso locale contenente 14 mg di piroxicam. Tale farmaco per uso topico agisce senza assorbimento sistemico del principio attivo; vale a dire che questo cerotto medicato contenente 14 mg di piroxicam (farmaco test) deve essere considerato come Topical Drug Delivery System e non come Transdermal Drug Delivery System (TDDS).
Infatti, la biodisponibilità del principio attivo dopo l’applicazione del cerotto è del tutto trascurabile. Per tale motivo la sperimentazione è stata compiuta in accordo con le linee guida EMEA CPMP/EWP/ 239/95 (Note for guidance on the clinical requirements for locally applied, locally acting products containing Known Constituents); CPMP/EWP/QWP/1401/98 (Note for Guidance on the Investigation of Bioavailability and Bioequivalence Committee for Proprietary Medicinal Products) e non con le linee guida CPMP/ QWP/604/96 che riguardano i sistemi transdermici ad azione sistemica (TDDS).
Questo studio clinico è stato effettuato per valutare la sicurezza, la concentrazione plasmatica, e la tollerabilità locale di un nuovo prodotto contenente piroxicam 14 mg formulato come cerotto medicato per uso topico in confronto ad una crema contenente piroxicam.
Disegno dello Studio
Lo studio clinico aperto, randomizzato in crossover ha coinvolto 26 volontari sani di età compresa tra i 18 e i 55 anni e di origine caucasica, i quali sono stati sottoposti ai due seguenti trattamenti:
1) Formulazione Test: cerotto medicato contenente 14 mg di piroxicam applicato una volta al giorno per otto giorni consecutivi (piroxicam patch 14 mg);
2) Formulazione Reference: piroxicam crema 1% applicata 3 volte al giorno per otto giorni consecutivi.
La durata dello studio è stata di 8 giorni, periodo di tempo che riflette la comune pratica clinica dei farmaci anti-infiammatori non steroidei (FANS) somministrati per via topica. I due trattamenti sono stati separati da un periodo di washout di nove giorni.
Durante gli otto giorni di trattamento i volontari partecipanti allo studio sono stati sottoposti anche ad una serie di prelievi ematici ed in particolare:
- prelievi basali durante i giorni 1-7 (pre-dose) T0/gg1, T0/gg2, T0/gg3, T0/gg4, T0/gg5, T0/gg6, T0/gg7 e T0/gg8 prima dell’ unica applicazione giornaliera della formulazione test e della prima delle tre della formulazione reference;
- prelievi (post-dose) dopo l h, 2h, 4h, 6h, 8h, 10h, 12h, 24h, 36h, 48h e 72h raccolti nei giorni 8 (l’ultimo giorno di trattamento), 9, 10 e 11.
Per la valutazione della tollerabilità e della adesività sono state eseguite delle visite giornaliere (al mattino e alla sera) durante i seguenti giorni di trattamento: 2, 4, 6, 8 e 9 (solo al mattino).
In particolare, mentre la tollerabilità locale (oggettiva e soggettiva) è stata valutata durante entrambe le suddette visite giornaliere, l’adesività del cerotto è stata valutata solo nel corso della visita mattutina e tramite foto scattate dagli sperimentatori.
Il disegno dello studio è stato scelto in accordo alle seguenti linee guida dell’EMEA: “Note for guidance on investigation of bioavailability and bioequivalence” (CPMP /EWP/QWP/1401/98) e “Note for guidance on clinical requirements for locally applied, locally acting products containing known constituents” (CPMP/EWP/239/95) le quali stabiliscono che per formulazioni topiche non comportanti un assorbimento sistemico del principio attivo, la determinazione della bioequivalenza in termini di concentrazioni plasmatiche, 1) non è applicabile, 2) non rappresenta un metodo adeguato per dimostrare l’equivalenza terapeutica. Tuttavia poiché la determinazione dei livelli plasmatici può avere un ruolo per la valutazione della sicurezza, quest’ultima è stata valutata nel presente studio clinico per la formulazione test, comparandola con quella di una formulazione reference già presente in commercio. È stata anche eseguita la valutazione della tollerabilità locale della formulazione test (oggettiva e soggettiva) e comparata con quella della formulazione reference.
Obiettivi dello studio
Obiettivo primario dello studio: valutare la tollerabilità locale e verificare il non assorbimento sistemico dopo somministrazione multipla del piroxicam per via topica. Obiettivo secondario dello studio: valutare la adesività e la sicurezza della formulazione test (piroxicam 14 mg, cerotto medicato).
Criteri di valutazione
Per la valutazione della tollerabilità locale è stato utilizzato un sistema a punteggio per quantificare sia segni oggettivi quali edema, eritema e desquamazione sia sintomi che risentono maggiormente della soggettività come prurito, bruciore e dolore.
La tollerabilità locale oggettiva è stata valutata dagli sperimentatori per due volte al giorno durante i giorni 2, 4, 6, 8 e 9 (solo una volta) di ciascun periodo, utilizzando la seguente scala numerica di grado di irritazione “Irritation Score” (IS):
0 = nessuna evidenza di irritazione;
1 = minima evidenza di eritema,
appena percettibile;
2 = eritema evidente, ben visibile, minima
visibilità di edema/papule;
3 = eritema e papule;
4 = edema evidente e ben definito;
5 = eritema, edema e papule definite;
6 = eruzione vescicolare;
7 = forte reazione con coinvolgimento di
aree cutanee oltre il sito di applicazione.
Il valore medio del grado di irritazione locale oggettivo (IS), la corrispondente deviazione standard (SD), il valore minimo e quello massimo per ciascuna visita e per formulazione sono stati calcolati tramite Microsoft Office Excel™. Inoltre il CIS ovvero Cumulative Irritation Score per soggetto ed il TS, il Total Cumulative Irritation Score per soggetto e per tutti i giorni di trattamento sono stati calcolati.
Il TS è stato calcolato secondo il sistema di interpretazione Berger & Bowman (R.S. Berger and J.P. Bowman “A reappraisal of the 21-Day cumulative irritation test in man” J. Toxicol – Cut. & Ocular Toxicol., 1(2) 109-115 (1982). Al fine di conformarsi con le formule utilizzate nel sistema Berger & Bowman, si è tenuto conto del valore massimo delle due osservazioni di tollerabilità effettuate nei giorni 2, 4, 6, 8 e dell’unico valore del giorno 9.
Quindi, le formule per il calcolo del CIS e del TS sono state modificate come segue:
CIS = ∑max(IS) (Irritation Score), calcolata per ogni soggetto e su tutti i giorni di trattamento;
TS = ∑CIS (Cumulative Irritation Score), calcolata per trattamento: TS test e TS reference.
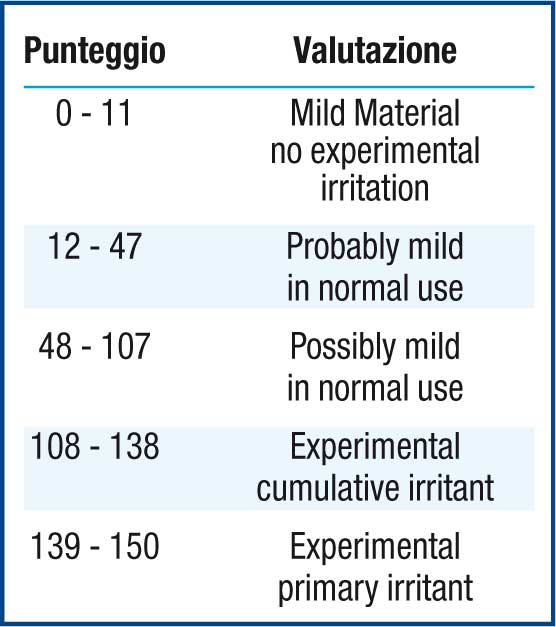
Il valore cumulativo utilizzato da Berger & Bowman è stato calcolato basandosi su un trial clinico condotto su gruppi di 10 soggetti ed effettuando 21 osservazioni per soggetto. Nel caso del presente studio (26 soggetti e 5 osservazioni per soggetto), il TS deve essere corretto ovvero riportato in base 10 tramite la formula seguente:
[TScorretto = TSottenuto x 10/26].
Inoltre, per ottenere un sistema di classificazione analogo a quello utilizzato da Berger & Bowman (che prevede un TS massimo possibile pari a 630, ovvero = score di 3 x 10 soggetti x 21 osservazioni), le categorie sono state definite utilizzando le stesse percentuali del possibile totale, calcolato stavolta tenendo in considerazione 5 osservazioni per soggetto pertanto TS di 150 = score di 3 x 10 soggetti x 5 osservazioni. Per il calcolo del TS, il limite pari a “3” di score è stato selezionato perché lo scopo di questo studio è stato quello di investigare la tollerabilità locale di formulazioni topiche quali il cerotto (test) e la crema (reference), la cui applicazione difficilmente comporta un grado di irritazione superiore a “3” che corrisponderebbe ad una irritazione cutanea estrema. (Tabella 1) La tollerabilità locale soggettiva è stata valutata per due volte al giorno durante i giorni 2, 4, 6, 8 e 9 (solo una volta) di ciascun periodo. Nel corso di ciascuna visita al soggetto è stato chiesto di riportare allo Sperimentatore Principale e/o co-Sperimentatore possibili segni e/o sintomi quali prurito, bruciore o dolore usando la seguente scala numerica:
0 = assente;
1 = lieve;
2 = moderata;
3 = severa.
Per la valutazione della adesività della formulazione test è stata presa in considerazione la percentuale di superficie del cerotto che rimaneva adesa alla pelle del soggetto prima della rimozione dello stesso e la quantità di sostanza adesiva residua in seguito alla rimozione del cerotto.
Per esprimere e quantificare l’adesività del cerotto alla pelle, la seguente scala numerica è stata utilizzata:
0 = >90% di adesività (essenzialmente
nessun distacco del cerotto dalla pelle);
1 = da >75% a <90% di adesività
(sollevamento solo di alcune parti);
2 = da >50% a <75% di adesività
(distacco di meno della metà
del cerotto);
3 = < 50% di adesività (distacco di più della
metà del cerotto ma senza caduta dello stesso);
4 = distacco completo del cerotto.
Il valore medio dei dati di adesività, la SD, il valore minimo e quello massimo per ciascuna visita e per formulazione sono stati calcolati tramite Microsoft Office Excel™.
Per valutare la quantità di sostanza adesiva residua in seguito alla rimozione del cerotto la seguente scala è stata utilizzata:
0 = nessuna traccia di sostanze adesive;
mT = tracce minime di sostanze adesive;
+ = poche tracce di sostanze adesive;
++ =alcune tracce di sostanze adesive;
+++ = molte tracce di sostanze adesive.
Per potere calcolare il valore medio, la SD, il massimo ed il minimo di quantità di sostanza adesiva residua la scala sopra descritta è stata convertita nella seguente scala numerica:
• nessuna traccia di sostanze adesive = 0;
• tracce minime di sostanze adesive = 1;
• poche tracce di sostanze adesive = 2;
• alcune tracce di sostanze adesive = 3;
• molte tracce di sostanze adesive = 4.
Il valore medio dei dati di quantità di sostanza adesiva, la SD, il valore minimo e quello massimo sono stati calcolati tramite Microsoft Office Excel™.
Per la valutazione della sicurezza sono stati presi in considerazione:
- l’insorgenza, la frequenza, l’intensità
degli eventi avversi (AE) e la loro possibile relazione con il trattamento applicato;
- gli eventuali cambiamenti dei parametri vitali tra la visita pre- e post-studio;
- risultati anormali dei test routinari di
laboratorio eseguiti durante le visite di pre- e post-studio.
Infine la valutazione del non assorbimento sistemico del principio attivo è stata eseguita in termini di AUClast (area sotto la curva concentrazione plasmatica-tempo calcolata dai valori di concentrazione plasmatica ottenuti in seguito all’analisi dei campioni biologici raccolti durante l’ultimo giorno di trattamento [giorno 8] ed i successivi 9, 10 ed 11).
In particolare l’AUClast è stata utilizzata per determinare la biodisponibilità relativa del piroxicam somministrato per via topica rispetto a quella orale.
Metodi statistici
L’analisi farmacocinetica, ovvero l’ottenimento (Cmax, Cmin e Tmax) ed il calcolo (AUClast) dei parametri di farmacocinetica, è stata eseguita tramite il software KINETICA™ (InnaPhase. 1700 Race Street – Philadelphia, PA 19103) utilizzando il metodo non-compartimentale.
L’analisi statistica descrittiva dei parametri farmacocinetici è stata eseguita tramite lo stesso software. Inoltre per dare un significato statistico ai dati di biodisponibilità relativa delle due formulazioni, un intervallo di confidenza del 95% (IC 95%) è stato costruito attorno ai valori di biodisponibilità relativa di entrambe le formulazioni (crema/reference e cerotto/test) espressi in percentuale, ovvero la biodisponibilità relativa sistemica ottenuta in seguito alla somministrazione topica giornaliera di 14 mg di piroxicam (contenuti nella formulazione test e reference) è stata confrontata con la biodisponibilità relativa sistemica ottenuta qualora la stessa dose venisse somministrata per via orale (International Journal of Pharmaceutics 295, 2005, 129-134, c. Rasetti-Escargueil, Pharmacokinetic profiles of two tablet formulations of piroxicam). La statistica descrittiva invece per i dati relativi alla tollerabilità locale e alla adesività sono state calcolate usando SPSS 13 e/o Microsoft Office Excel™.
Risultati e discussione
Tollerabilità locale
I risultati della tollerabilità locale oggettiva sono riportati in tabella 2.
I dati riportati in tabella 2 suggeriscono che sia la formulazione test sia quella reference sono state ben tollerate infatti il
TScorretto (riportato cioè in base 10) è risultato essere entro il limite della prima categoria del sistema di classificazione (0-11), non mostrando essenzialmente alcuna evidenza di irritazione. Infine tra le due formulazioni non ci sono differenze statisticamente significative (p > 0.1, Wilcoxon Signed-Rank Test).
Per quel che riguarda la valutazione della tollerabilità locale soggettiva sono state riportate in tabella 3 solo le seguenti valutazioni per i soggetti 17 per la formulazione test, e 6 e 19 per la formulazione reference:
Adesività
Nella tabella 4 sono riportati i dati relativi alla adesività che dimostrano che l’adesività del cerotto è risultata essere molto buona; infatti i valori medi sono risultati essere compresi tra 0 e 1, cioè in termini di percentuale tra il 75-90%, solo in due soggetti la adesività è risultata essere pari a “2” ovvero compresa tra il 50% ed il 75%.
I dati riportati in tabella 5 dimostrano che la formulazione test non lascia sulla pelle quantità rilevanti di sostanza adesiva infatti il valore medio è risultato essere compreso tra “0” e “1” ovvero “nessuna traccia di sostanze adesive” e “tracce minime di sostanze adesive”.
Sicurezza
Nessun AE si è verificato; e i parametri vitali e i risultati dei test routinari di laboratorio eseguiti durante le visite di pre- e post-studio sono rimasti inalterati.
Assorbimento sistemico
Biodisponibilità formulazione Test e Reference
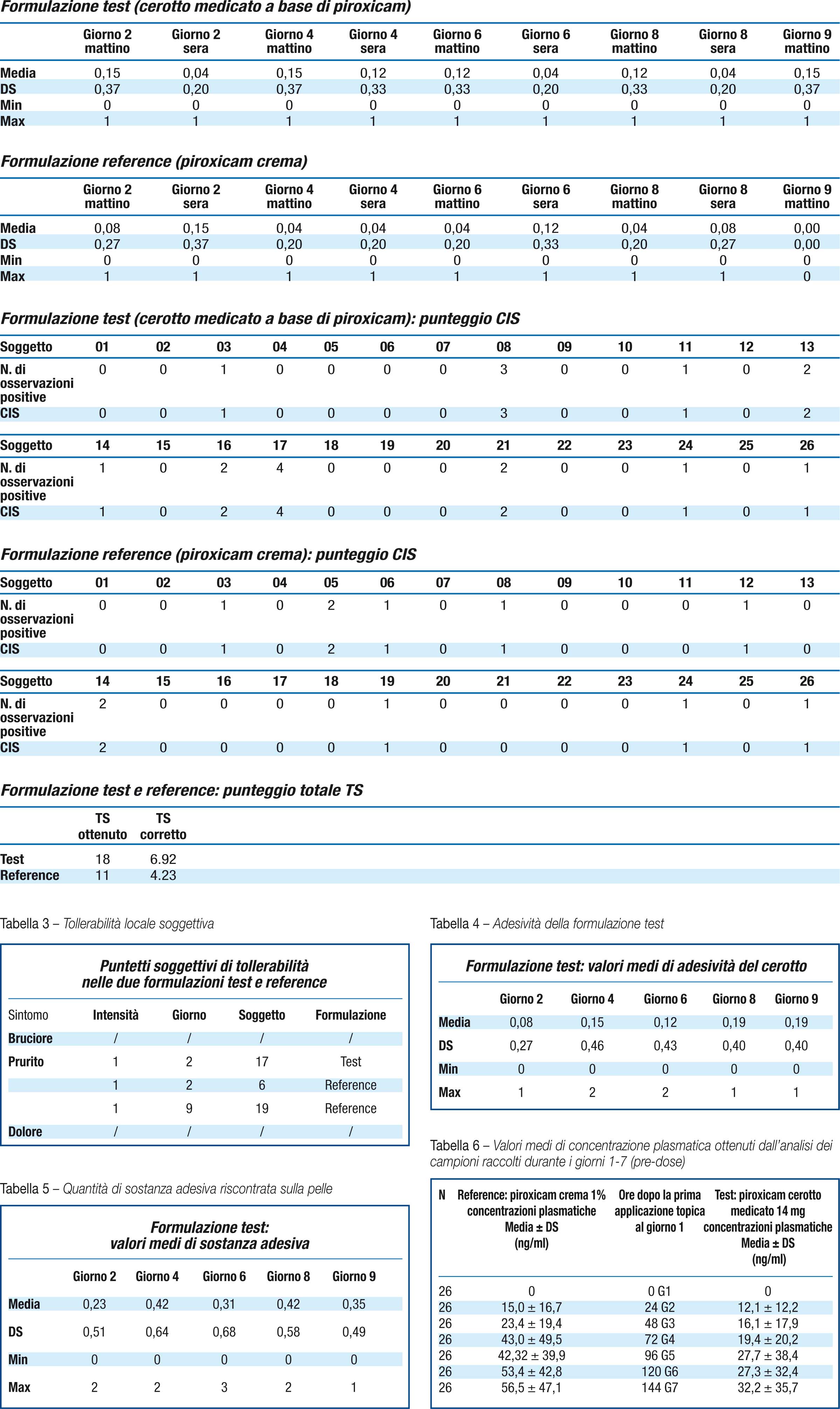
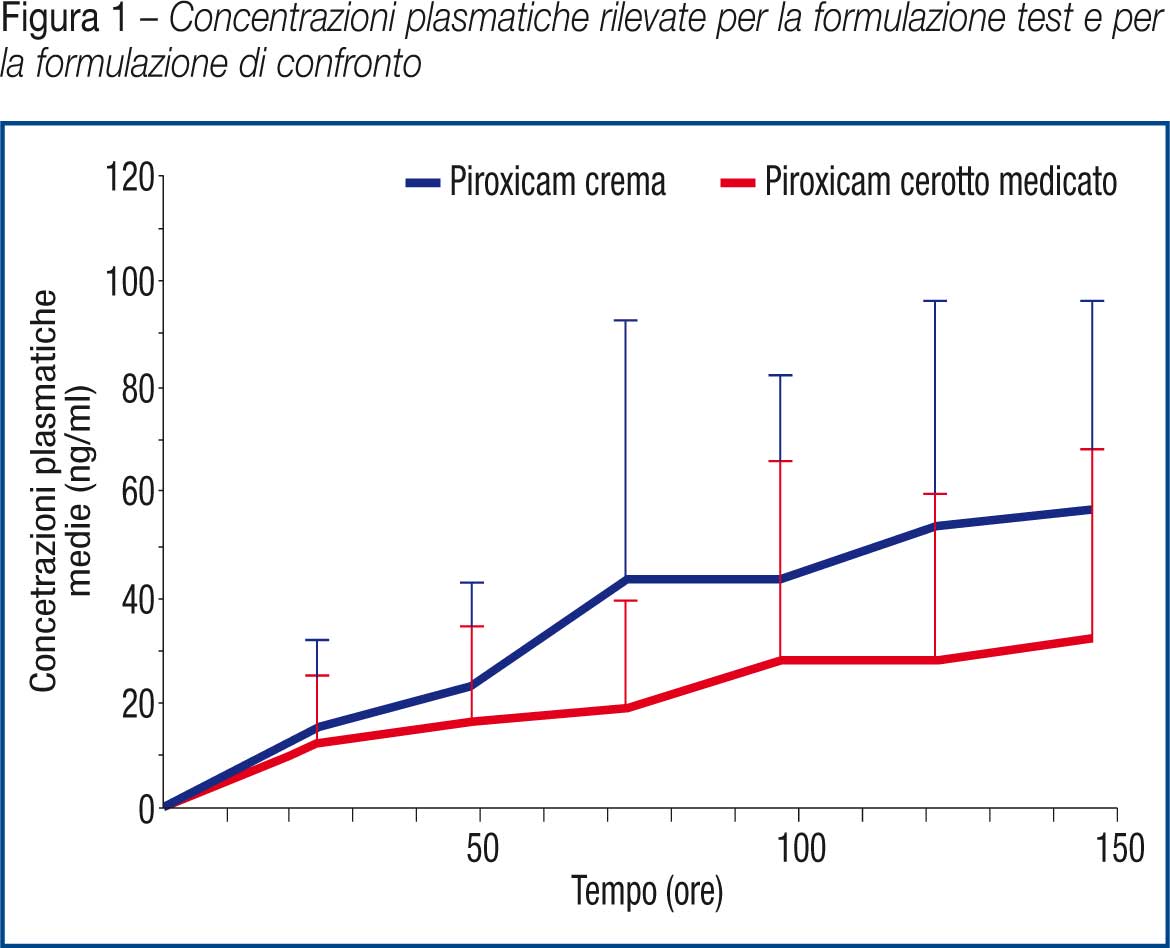
Si riportano in tabella 6 e figura 1 i valori medi di concentrazione plasmatica ottenuti dall’analisi dei campioni raccolti durante i giorni 1-7 (pre-dose) T0/gg1, T0/gg2, T0/gg3, T0/gg4, T0/gg5, T0/gg6 e T0/gg7.
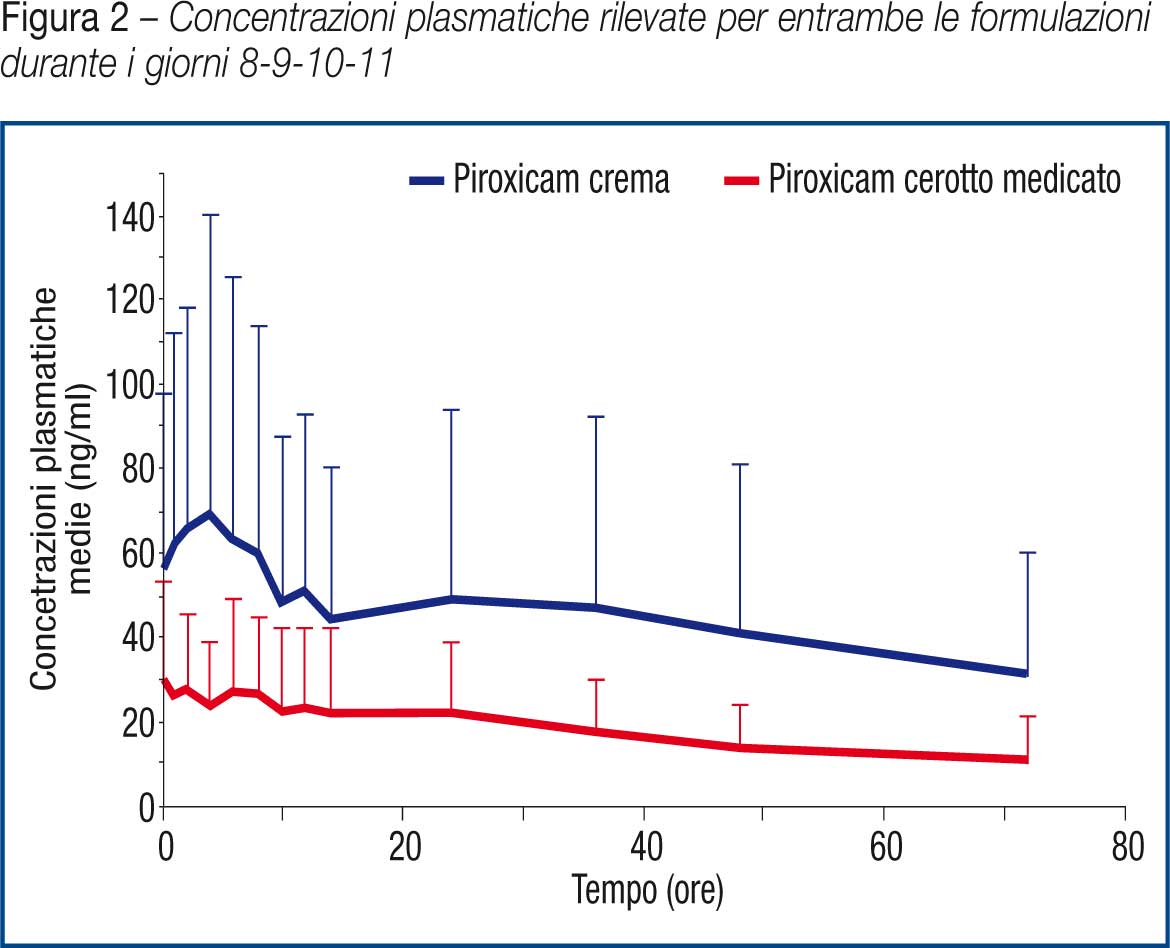
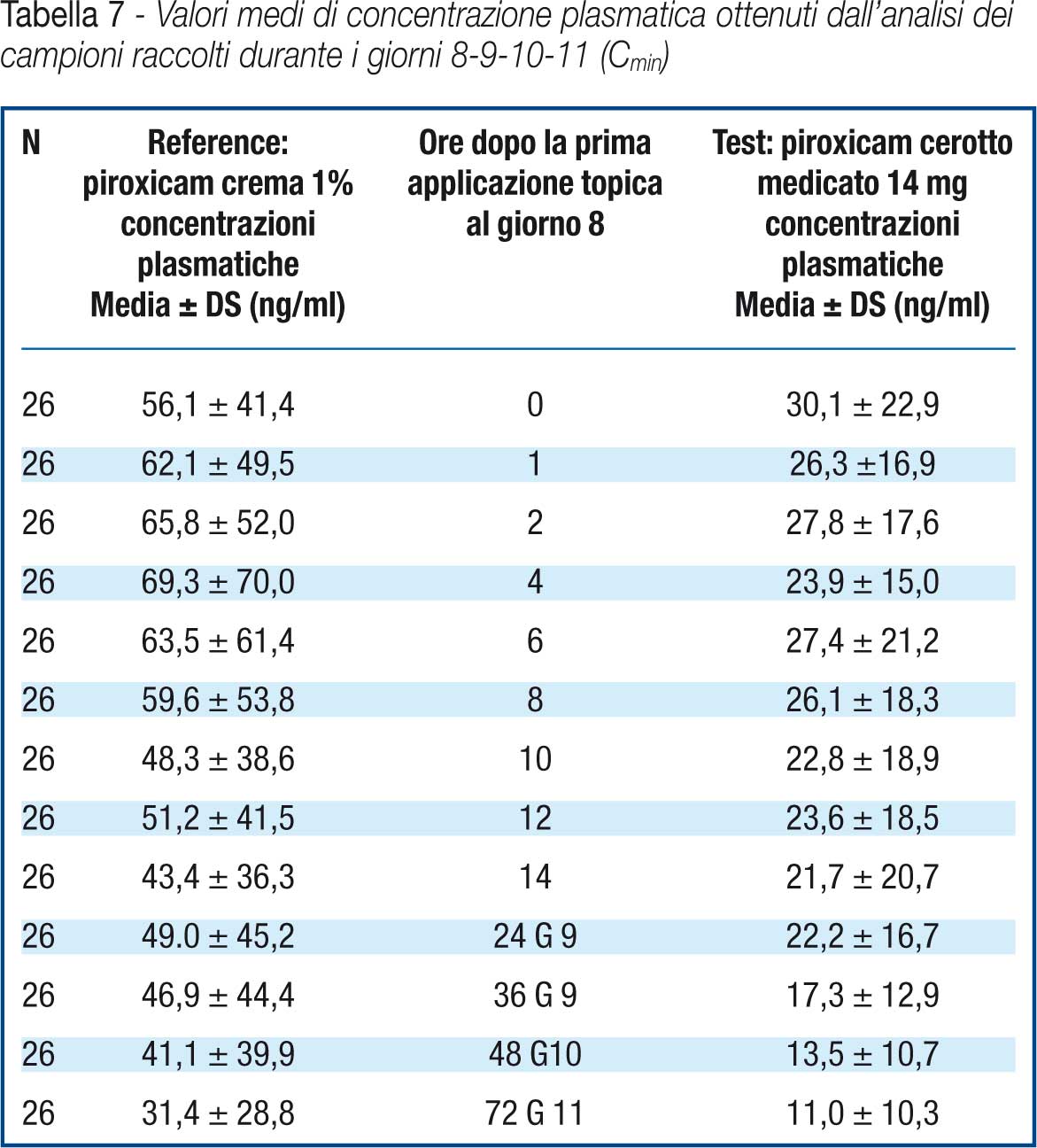
Si riportano in tabella 7 e in figura 2 i valori medi di concentrazione plasmatica ottenuti dall’analisi dei campioni raccolti durante i giorni 8-9-10-11 (Cmin).
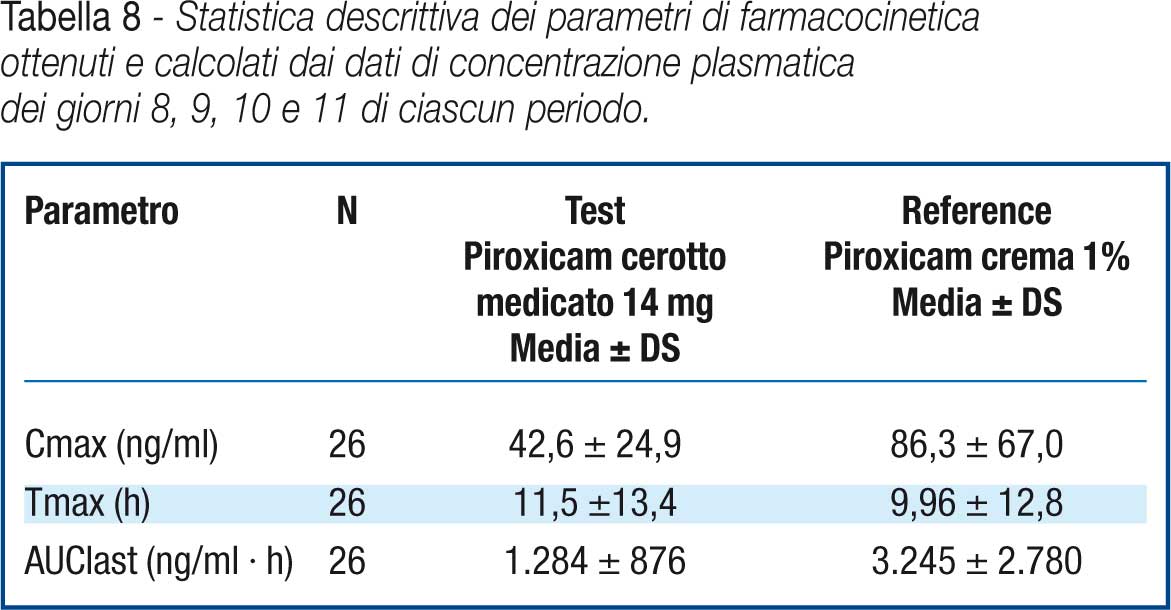
Le concentrazioni plasmatiche di piroxicam hanno dimostrato raggiungere un plateau al giorno ottavo e questo sta ad indicare che nessuna delle due formulazioni utilizzate in questo studio ha mostrato l’effetto “dose dumping” ovvero il rilascio immediato ed improvviso del principio attivo. Data l’alta variabilità dei dati di concentrazione plasmatica, l’AUClast resta l’unico parametro farmacocinetico che permette di valutare la biodisponibilità relativa del piroxicam dopo l’applicazione delle due formulazioni. (Tabella 8)
I dati sopra riportati dimostrano come l’assorbimento sistemico del piroxicam in seguito a somministrazione topica sia caratterizzato da una alta variabilità che è una peculiarità dei prodotti topici come gel, creme e cerotti.
In particolare i risultati ottenuti evidenziano come tale variabilità sia più accentuata per la formulazione reference (piroxicam crema 1%).
Inoltre è stato possibile osservare come sia la Cmax sia l’AUClast ottenute in seguito alla somministrazione del piroxicam cerotto siano inferiori a quelle ottenute dopo l’applicazione della formulazione reference.
In particolare l’IC 95% costruito attorno al valore medio percentuale di biodisponibilità relativa sistemica ottenuta in seguito alla somministrazione topica di 14 mg di piroxicam relativa a quella che si avrebbe qualora la stessa dose venisse somministrata per via orale è risultato essere pari
a 1.19-2.09% per il test e 2.72-5.60% per il reference.
Conclusioni
Sia la formulazione test (piroxicam 14 mg cerotto medicato) sia quella reference (piroxicam 1% crema) hanno dimostrato avere una buona tollerabilità locale oggettiva e soggettiva. Solo pochissimi soggetti hanno riportato lievi irritazioni cutanee. L’adesività della formulazione test è risultata essere molto buona.
Nel caso di prodotti topici le concentrazioni plasmatiche di principio attivo hanno rilevanza nel dimostrare il non assorbimento sistemico del principio attivo che nel caso dei FANS rappresenta un vantaggio poiché associato ad una minore incidenza degli effetti collaterali a carico del tratto gastrointestinale.
In seguito alla analisi statistica delle concentrazioni plasmatiche di piroxicam, possiamo concludere che la somministrazione topica del piroxicam per entrambe le formulazioni determina un assorbimento sistemico non associato ad attività farmacologica che si esplica invece solamente a livello della zona di applicazione (studio di efficacia).
Pertanto i dati ottenuti assicurano la sicurezza della formulazione test in termini di concentrazione plasmatica.
Infine, osservando i dati di biodisponibilità relativa e di tollerabilità locale del piroxicam dopo applicazione della formulazione test (cerotto contenente 14 mg di piroxicam) e di quella reference, possiamo dire che la sicurezza del cerotto contenente 14 mg di piroxicam, è risultata essere simile o superiore a quella di piroxicam in formulazione crema 1%. ■
Bibliografia
- C. Rasetti-Escargueil, V. Grangé Pharmacokinetic profiles of two tablet formulations of piroxicam International Journal of Pharmaceutics 295 (2005) 129-134.
- Jinying Lin, Weiya Zhang, Adrian Jones, Michael Doherty Efficacy of topical non-steroidal anti-inflammatory drugs in the treatment of osteoarthritis: meta-analysis of randomised controlled trials BMJ 2004;329:324.
- World Medical Association Declaration of Helsinki. Ethical Principles for Medical Research Involving uman Subject. 52nd WMA General Assembly, Edinburgh, Scotland, October 2000.
- The European Agency for the Evaluation of Medicinal Products. Note for Guidance on Good Clinical Practice. July 2002 CPMP/CH/135/95.
- CPMP/EWP/239/95 Note for Note for guidance on the clinical requirements for locally applied, locally acting products containing Known Constituents.
- R.S. Berger and J.P. Bowman” A reappraisal of the 21-Day cumulative irritation test in man” J. Toxcol – Cut. & Ocular Toxicol., 1(2) 109-115 (1982).
- Tessari L, Ceciliani L, Belluati A. “Aceclofenaccream versus piroxicam cream” Curr. Ther. Research – Vol 56, 7, July 1995.
- R.A van Haselen and A.G. Fisher “ A randomized controlled trial camparing topical piroxicam” – Rheumatology 2000;39: 714-719.
top