Vitamina D: review della letteratura
A cura di M. Muratore, L. Quarta,
U.O. di Reumatologia Ospedale Galateo San Cesario di Lecce
Gli studi condotti negli ultimi anni sul meccanismo d’azione e sugli effetti della vitamina D hanno messo in evidenza importanti effetti metabolici sul tessuto muscolare e potenti effetti immunomodulatori su molti tipi cellulari (compresi quelli del sistema immune), oltre agli effetti ormai noti esercitati sul metabolismo fosfo-calcico e sul mantenimento della massa ossea.
La vitamina D (1) è presente in alcuni alimenti di origine vegetale (ergocalciferolo o vitamina D2) ed animale (colecalciferolo o vitamina D3) come carne, pesce (salmone, sardine, tonno), uova, fegato.
La principale fonte però di vitamina D3 è la cute, a livello della quale viene prodotta grazie all’azione dei raggi UVB sui precursori steroidei durante l’esposizione alla luce solare.
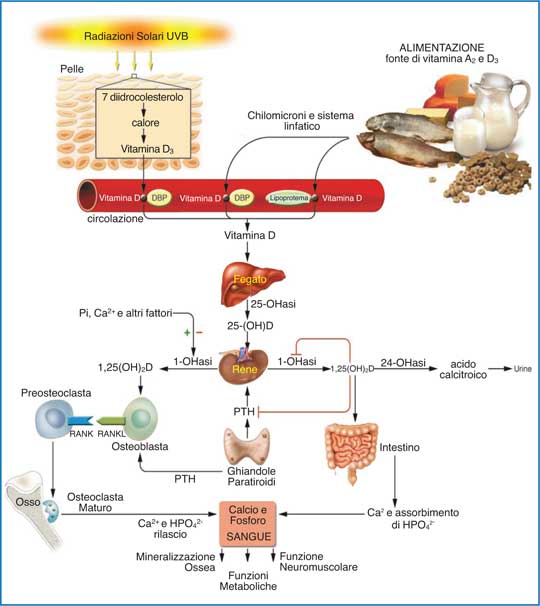
Sia la vitamina D2 che la D3 si legano alle DPB (vitamin D binding protein) e vengono trasportate al fegato dove sono idrossilate a 25-idrossivitamina D (25(OH)D) o calcifediolo, principale metabolita circolante utilizzato come indicatore dello stato vitaminico D di un soggetto. La 25(OH)D, biologicamente inattiva, viene trasportata nei tubuli renali e convertita nei mitocondri dalla 1?-idrossilasi in 1,25-di-idrossi-vitamina D (1,25(OH)2D3) o calcitriolo, metabolita biologicamente attivo e responsabile del mantenimento della omeostasi del calcio e del fosforo. La sua sintesi è regolata con un meccanismo di feed-back negativo dal paratormone (PTH) e dalla concentrazione ematica dello stesso calcitriolo.
Gli organi bersaglio del calcitriolo sono l’intestino, il tessuto osseo e le paratiroidi. Stimola, infatti, l’assorbimento intestinale del calcio e del fosforo, usati poi nel processo di mineralizzazione ossea (2,3).
Nei casi di ipocalcemia il calcitriolo (1,25(OH)2D3) come il PTH riporta la calcemia ai valori normali regolando così l’omeostasi calcica (2,3).
Fra i meccanismi omeostatici è stato evidenziato negli ultimi anni il rapporto del calcitriolo con il recettore attivante l’NFk (RANK), il ligando del recettore attivante l’NFk (RANKL) e l’Osteoprotegerina (OPG) - sistema RANK/RANKL/OPG - fondamentale nel riassorbimento osteoclastico e nel rimodellamento osseo. Il calcitriolo induce infatti l’espressione del RANKL sulla superficie degli osteoblasti stimolando il riassorbimento osseo (3-5).
Recettori per la vitamina D (VDR) sono stati trovati anche nel tessuto muscolare e nei nervi, indicando un ruolo indiretto nella coordinazione neuromuscolare e uno diretto attraverso la sintesi ex novo di proteine muscolari (6). È stato infatti dimostrato in topi privi del gene per la VDR una ridotta dimensione delle fibre muscolari così come una significativa riduzione dell’espressione del VDR nel tessuto muscolare umano con l’avanzare dell’età. Una correlazione positiva esiste tra la forza muscolare ed i livelli sierici e la funzione della vitamina D nei soggetti più anziani. Questo suggerisce che la minore forza e funzione muscolare indotta da processi infiammatori e/o dai glucocorticoidi e la minore forza e funzione muscolare osservata con l’avanzare dell’età insieme al maggiore rischio di cadute potrebbe essere in parte legata ad una riduzione o alterazione del VDR negli organi bersaglio (intestino, osso, rene, paratiroidi, linfociti T e B attivati, monociti/macrofagi, cellule dendritiche) e ad una riduzione o resistenza alla vitamina D nel siero. Questo spiegherebbe il miglioramento della forza muscolare, delle capacità posturali ed il minor rischio di caduta in soggetti anziani quando sono trattati con analoghi della vitamina D (2,7,8).
È stata dimostrata l’espressione del VDR anche in cellule neoplastiche della prostata, della mammella, del colon, nelle cellule leucemiche, nel sarcoma di Kaposi e nelle cellule del carcinoma a cellule squamose (9).
Si è visto che i ligandi del VDR inibiscono in vivo la crescita del tumore primitivo prostatico e delle metastasi ed agiscono sulle cellule del carcinoma prostatico favorendo l’arresto della crescita allo stadio G0/G1 del ciclo cellulare, l’apoptosi, la differenziazione cellulare delle cellule cancerose e l’interazione con il signaling degli androgeni (9, 10). In particolare è stato dimostrato che il calcitriolo inibisce sia la proliferazione delle cellule cancerose androgeno-dipendenti che quelle non androgeno-dipendenti (9).
Effetti analoghi sono esercitati dal calcitriolo nel carcinoma mammario. Studi in vitro ed in vivo hanno infatti dimostrato che il calcitriolo ed i suoi analoghi sintetici inibiscono rispettivamente la proliferazione delle cellule del carcinoma mammario e la progressione del tumore (9,11). I ligandi del VDR sono efficaci sulle cellule recettore estrogenico-positivo e negativo e favoriscono l’arresto della crescita cellulare nella fase G0/G1, l’apoptosi e l’inibizione della angiogenesi riducendo così il potenziale inva-sivo /metastatico delle cellule del carcinoma mammario (9).
Con meccanismi analoghi il calcitriolo ed i suoi analoghi sintetici inibiscono la proliferazione della cellule cancerogene del colon e del carcinoma a cellule squamose (9).
| Figura 1 - Rappresentazione schematica della fotoproduzione e del metabolismo della vitamina D e dei vari effetti biologici del metabolita attivo 1,25(OH)2D sul metabolismo del calcio, del fosforo e dell’osso. (Mod. da: 3. Holick MF. J Clin Invest., 2006) |
 |
Legenda:
1-OHase (25-hydroxyvitamin
D-1?-hydroxylase):
25-idrossivitamina D-1a-
idrossilasi;
1,25(OH)2D
(1,25-dihydroxyvitamin D):
1,25-diidrossivitamina D;
25(OH)D (25-hydroxyvitamin D): 25-idrossivitamina D;
DBP (vitamin D-binding protein): proteina di legame
con la vitamina D;
FGF23 (fibroblast growth factor 23): fattore di crescita
fibroblastica 23;
NF-kB (nuclear factor-kB):
proteina complessa
che rappresenta un fattore
di trascrizione;
PHEX (phosphate-regulating endopeptidase homolog,
X-linked): omologo X-linkato
di regolazione
della endopeptidasi fosfatica;
PTH (parathyroid hormone): ormone paratirodeo;
RANKL (receptor activator
of NF-kB ligand): ligando del Recettore di Attivazione
del NF-kB;
RXR (retinoic acid X receptor;): recettore per l’acido retinoico X;
SPF (sun protection factor):
fattore di protezione solare;
UVB (ultraviolet B):
raggi ultravioletti tipo B;
VDR (vitamin D receptor):
recettore della vitamina D;
VDRE (vitamin D-responsive element): elemento responsivo alla vitamina D. |
Regolazione del processo di formazione osseo
Studi recenti sembrano indicare che il calcitriolo e gli analoghi della vitamina D siano in grado di svolgere una attività di regolazione delle formazione ossea, sebbene il meccanismo attraverso cui questo avviene non sia ancora del tutto chiarito.
In uno studio condotto su un modello di topi ormono-dipendenti con osteoporosi senile (SAM-P/6) caratterizzati da riduzione del processo di formazione ossea, due gruppi di animali sono stati trattati rispettivamente con calcitriolo o placebo allo scopo di verificare l’effetto del calcitriolo sulla formazione ossea. (12)
Gli animali sono stati osservati per un periodo di 6 settimane al termine del quale, nel gruppo in trattamento con calcitriolo, è stato osservato un significativo e rapido incremento della BMD a livello della colonna lombare (p<0,001) rispetto a quanto osservato nel gruppo di controllo (12). (Figura 2)
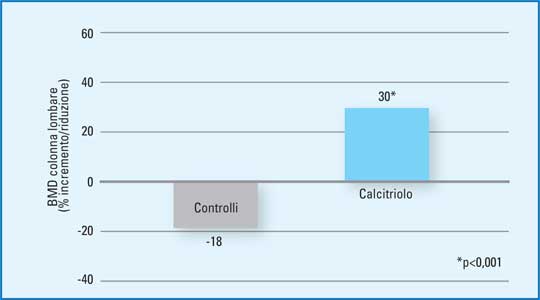 |
Figura 2 - BMD a livello della colonna lombare. Studio su animali da esperimento selezionati per osteoporosi senile.
*p<0,001. (mod da 12 - Duque G et al., Am J Physiol Endocrinol Metab 2005). |
L’esame istomorfometrico statico e dinamico ha indicato che il calcitriolo aumenta in maniera significativa il volume dell’osso, altri parametri relativi alla qualità ossea e la formazione dell’osso subperiostiale, rispetto a quanto osservato nel gruppo di controllo; inoltre, sono stati rilevati aumenti significativi dei markers di formazione ossea e riduzioni importanti di quelli di riassorbimento.
Queste osservazioni hanno dimostrato che il calcitriolo agisce simultaneamente sulla formazione e sul riassorbimento ossei consentendo, così, di prevenire l’instaurarsi dell’osteoporosi senile.
Livelli di stato vitaminico D e l’assunzione giornaliera
adeguata di vitamina D.
Considerata l’importanza della vitamina D ed i suoi molteplici effetti si è reso necessario ridefinire i livelli di stato vitaminico D (2,13,14). Pur in assenza di un consenso generale, la concentrazione ottimale e quella di carenza o grave insufficienza di 25(OH)D è stata inclusa in un ampio range che va da 20 a 120nmol/L (8-48ng/ml). Tuttavia concentrazioni di 75 nmol/L (30ng/ml) sono ad oggi ritenute il limite inferiore dell’intervallo ottimale capace di garantire un buon assorbimento intestinale di calcio e prevenire le fratture non vertebrali e le cadute. Si è dovuto così ridefinire anche l’assunzione giornaliera adeguata di vitamina D innalzata, oggi, a valori di almeno 800 UI/die (20mg) e oltre soprattutto in soggetti anziani e in donne in gravidanza e che allattano. L’assunzione giornaliera adeguata di vitamina D identificata nel 1997, pari a 5-15mg o 200-600UI per adulti di età superiore a 19 anni, è oggi ritenuta insufficiente.
In particolare nella donne in gravidanza e durante l’allattamento la dose di vitamina D consigliata è 1.000-2.000 UI di vitamina D3 al giorno o 50.000UI di vitamina D2 ogni 2 settimane (15).
Efficacia antifratturativa della vitamina D
Negli ultimi anni l’aspettativa di vita è notevolmente aumentata con un marcato incremento delle malattie correlate all’età, quali l’osteoporosi e le fratture legate alla osteoporosi (16). Il peso umano, economico e sociale di queste fratture ha reso necessario lo sviluppo di terapie non solo efficaci nella gestione della osteoporosi ma anche capaci di prevenire le fratture osteoporotiche (bisfosfonati, SERMs, ranelato di stronzio e PTH). Numerosi studi hanno ormai dimostrato l’efficacia di questi farmaci nel ridurre il rischio relativo di fratture in relazione al tipo e allo stadio di osteoporosi e al tipo di farmaco impiegato. Le evidenze degli ultimi anni (se pur con diversi limiti) hanno mostrato che l’associazione a questi farmaci di calcio e vitamina D può favorire un maggiore incremento della BMD, della forza dell’osso e un minore rischio di caduta e quindi di fratture (soprattutto in soggetti anziani istituzionalizzati e non). Gli studi hanno mostrato che la dose di vitamina D necessaria per raggiungere l’effetto terapeutico deve essere pari a 700-800UI/die. È stato addirittura dimostrato che il beneficio degli analoghi idrossilati della vitamina D sul rischio di caduta è duraturo e visibile anche in soggetti non completamente carenti di vitamina D e anche in pazienti inattivi (17,18). (Figura 3)
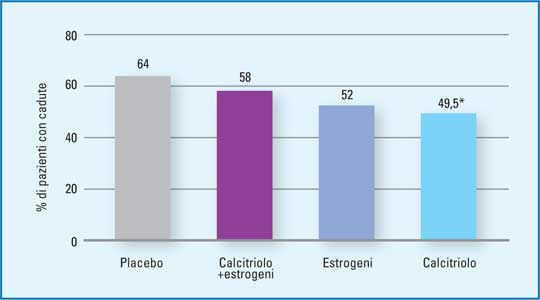 |
| Figura 3 - Percentuale di pazienti che hanno avuto una caduta nel corso di uno studio in doppio cieco controllato della durata di 3 anni condotto in 489 donne anziane (età 65-77 anni). (mod da 17 - Gallagher JC et al., J Steroid Biochem Mol Biol. 2007). |
Una recente metanalisi (19) che ha valutato i risultati di 7 trials randomizzati e controllati condotti sull’effetto della aggiunta della vitamina D e fratture d’anca in circa 10.000 pazienti anziani con deficit di vitamina D, ha mostrato una riduzione significativa del rischio di frattura femorale e non vertebrale nei soggetti che avevano un adeguato introito di vitamina D. (Figura 4)
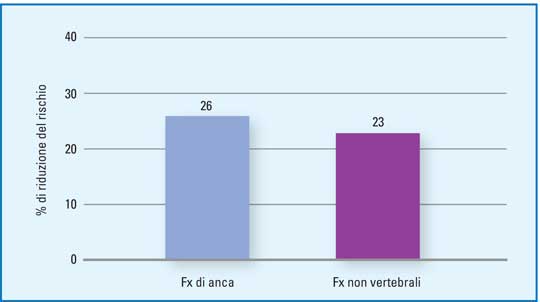 |
| Figura 4 - Riduzione del rischio di frattura osservato con calcitriolo. Metanalisi di 7 studi randomizzati e controllati su circa 10.000 soggetti (mod da 19 - Boonen S et al., J Clin Endocrinol Metab 2007) |
Calcitriolo e osteoporosi indotta da corticosteroidi
La letteratura internazionale suggerisce che le donne precocemente postmenopausali e i pazienti trattati con corticosteroidi dovrebbero ricevere una terapia preventiva per proteggere la loro Densità Minerale Ossea (BMD) e per evitare fratture da fragilità ossea. (20,21)
A tale scopo, è stata condotta una meta-analisi di studi sugli effetti della Vitamina D e dei suoi analoghi, con particolare attenzione al calcitriolo. Il periodo considerato è stato dal 1985 al 2003 e tutti gli studi presi erano randomizzati, controllati, in doppio cieco, nell’osteoporosi primaria o indotta da corticosteroidi. Le fonti sono state il Cochrane Controlled Trials Register (CCTR), EMBASE e MEDLINE. Tutti gli studi sono stati analizzati per accertarne eterogenicità ed eventuali bias e 33 sono stati ritenuti validi ai fini della meta-analisi (14 vitamina D, 19 analoghi della vitamina D).
I risultati, espressi come rapporto dimensione-effetto per la perdita ossea e come grado di differenza per le fratture, dimostrano, nelle pazienti con postmenopausa precoce, una superiore efficacia nel migliorare la BMD per gli analoghi rispetto alla vitamina D pura (p<0,0001) con differenze significative tra trattamenti a livello della colonna lombare. Anche per quanto riguarda il rischio relativo globale per fratture vertebrali, il grado di efficacia preventiva è risultato maggiore per gli analoghi della vitamina D. Nei pazienti con osteoporosi indotta da corticosteroidi sia calcitriolo sia la vitamina D hanno indotto lo stesso grado di efficacia per la perdita ossea anche se la BMD a livello della colonna è stata incrementata solo da calcitriolo (p<0,0001). L’efficacia degli analoghi, in particolare calcitriolo, e della vitamina D nella riduzione del rischio di fratture in questa tipologia di pazienti, non è risultata statisticamente significativa, anche se in studi di confronto diretto tra analoghi e vitamina D sul rischio di fratture a livello del collo del femore, gli analoghi hanno dimostrato maggiori effetti preventivi e protettivi. In conclusione, questa ampia meta-analisi consente di affermare che gli analoghi della vitamina D, in particolare calcitriolo, hanno dimostrato di essere efficaci nella prevenzione della perdita ossea e delle fratture in pazienti con osteoporosi primaria, comprese le donne postmenopausali. Nell’osteoporosi da glucocorticoidi, l’efficacia degli analoghi è differente a seconda degli approcci: il paragone indiretto porta a differenze non significative mentre il paragone testa a testa dimostra una differenza significativa a favore degli analoghi, in particolare calcitriolo. In questo caso gli analoghi sembrano prevenire le fratture vertebrali in misura maggiore rispetto alla vitamina D non idrossilata, ma tali evidenze necessitano di ulteriori conferme con studi di confronto a più bracci.(20,21)
Stato vitaminico e altre patologie reumatiche
Studi recenti hanno poi valutato lo stato vitaminico in diverse patologie reumatiche quali l’artrite reumatoide, la spondilite anchilosante, il lupus eritematoso sistemico e l’osteoartrosi. I risultati emersi hanno mostrato uno stato di ipovitaminosi D nella maggior parte di questi pazienti e in pazienti con artrite reumatoide è stata dimostrata addirittura una correlazione inversa tra attività di malattia e livelli sierici di 1,25 (OH)D e PTH, concludendo che nella AR l’elevata attività di malattia era associata ad una alterazione del metabolismo della vitamina D e ad un aumentato riassorbimento osseo. In pazienti con malattie infiammatorie croniche l’uso di corticosteroidi favorisce il riassorbimento osseo, riduce la formazione ossea e induce una alterazione del tessuto muscolare (16, 22, 23) aumentando così l’incidenza di cadute e fratture non vertebrali nei primi tre mesi di terapia (16,24). La vitamina D è capace di mantenere la massa ossea in pazienti che assumono corticosteroidi e può ridurre significativamente il rischio di fratture vertebrali. Recenti evidenze suggeriscono che gli effetti farmacologici deleteri dei corticosteroidi possono essere addirittura contenuti usando analoghi della vitamina D e che questi possono ridurre il rischio di caduta in pazienti con osteoporosi indotta da glucorticoidi (GIOP: glucocorticosteroid-induced osteoporosis) quando usati come trattamento di combinazione col bisfosfonato (16).
Conclusione
Alla base di un’ottimale terapia per l’osteoporosi e per la prevenzione di fratture osteoporotiche vi è l’incremento della massa e forza ossea, così come una riduzione delle cadute. Studi clinici e pre-clinici sui markers del metabolismo osseo, sulla densità minerale ossea e sulle fratture suggeriscono che la terapia combinata, di un bisfosfonato-vitamina D ha una maggiore efficacia assoluta e relativa nella prevenzione della perdita minerale ossea e nella prevenzione delle fratture a causa dei due diversi e complementari meccanismi d’azione. Importante è misurare ad intervalli regolari la calcemia in tutti i pazienti che ricevono dosi farmacologiche di vitamina D ed in particolare di calcitriolo per il rischio di ipercalcemia.
Bibliografia essenziale
1. Reichel H et al. N. Engl J Med 1989; 320:980-991.
2. Di Munno O et al., Clinical Cases in Mineral and Bone Metabolism 2007; 4(3): 7-12.
3. Holick MF. J Clin Invest. 2006; 116 (8):2062-72.
4. Khosla S. Endocrinology 2001; 142:5050-5
5. Russel RG et al. Curr Opin Rheumatol. 2006; 18 Suppl 1:S3-10.
6. Bischoff HA et al. Histochem J. 2001; 33(1): 19-24.
7. Snijder MB et al. J Clin Endocrinol Metab. 2006; 91(8):2980-5
8. Bischoff-Ferrari HA et al. JAMA. 2004; 291(16):1999-2006.
9. Cetani F. Clinical Cases in Mineral and Bone Metabolism 2007; 4(3): 31-38.
10. Getzenberg RH et al., Urology 1997; 50:999-1006.
11. Bortman P. et al. Braz J Med Biol Res. 2002; 35:1-9.
12. Duque G et al., Am J Physiol Endocrinol Metab 2005; 288 (4): E723-E730
13. Dawson-Hughes B et al. Osteoporos Int 2005; 16(7):713-6.
14. Bischoff-Ferrari HA. Osteoporos Int 2007; 18(4):401-7.
15. Bianchi ML et al., Clinical Cases in Mineral and Bone Metabolism 2007; 4(3): 19-23.
16. Schacht E. et al. J Musculoskelet Neuronal Interact 2007; 7(2):174-184.
17. Gallagher JC et al., J Steroid Biochem Mol Biol. 2007;103(3-5): 610-613
18. Richy F et al., Calcif Tissue Int. 2008; 82 (2): 102-107.
19. Boonen S et al., J Clin Endocrinol Metab 2007; 92: 1415-1423
20. Richy F et al., Osteoporos Int. 2004; 15 (4):301-10
21. Richy F et al., Calcif Tissue Int. 2005; 76 (3):176-86
22. DeLuca HF et al. FASEB J 2001; 15:2579-2585.
23. Greiwe JS et al. FASEB J 2001; 15:475-482.
24. Van Staa TP et al. J Bone Miner Res 2000; 15:993-1000. |
|
top