Autoinnesto di condrociti nella patologia traumatica
E. Abello, M.Guelfi, F. Priano
Casa di Cura Villa Montallegro, Genova
Si sono succedute varie tecniche chirurgiche di trapianto cartilagineo (auto,etero o allotrapianto) e tentativi di sostituzione protesica
della porzione di cartilagine lesionata con materiali inerti come le fibre di carbonio o polietilene. Oggi si è ormai riconosciuto,
in medicina la validità dei sistemi di autotrapianto, perché l’esperienza di laboratorio, ma soprattutto l’utilizzo clinico hanno portato a risultati a volte esaltanti nella cura di patologie svariate in campo specialistico. Si è visto pertanto che l’autotrapianto, se effettuato con tecniche adeguate porta ad una soluzione ottimale di molti problemi medici. è ormai conosciuta in tutto il mondo medico
la sperimentazione di Peterson e Brittberg di autoinnesto di condrociti. Questa tecnica parte dal presupposto che le cellule sane possono essere “trasferite” e “sostituire” le cellule “malate”: con un piccolo prelievo di cellule e quindi con scarso danno per il sito donatore,
si possono ottenere, un gran numero di cellule adatte a riparare la zona patologica. Alla luce dell’esperienza fatta in un trial clinico di autoinnesto di condrociti prelevati e trattati presso il Centro di Biotecnologie Avanzate di Genova, vogliamo, in questo lavoro, riferire alcune considerazioni cliniche sull’utilizzo della metodica aci nelle lesioni cartilaginee traumatiche. La nostra esperienza, iniziata
nei primi mesi del 1997, comprende oggi 48 casi di lesione osteocondrale condilica o di faccetta articolare della rotula di diametro superiore a cm.1,5, conseguente a lesione traumatica. Il protocollo di trattamento prevede il prelievo di porzione cartilaginea dalla
gola intercondilica, nell’immediatezza del trauma, l’invio del materiale in laboratorio di differenziazione cellulare dove le cellule
vengono manipolate e perfrigerate in attesa dell’auto-innesto. Abbiamo trattato solo i pazienti che, secondo i criteri dello studio
di Peterson presentavano ancora sintomatologia soggettiva ed oggettiva della patologia cartilaginea a distanza di almeno sei mesi
dall’evento lesionale e dal prelievo cartilagineo. Nella seconda fase di trattamento, in accordo con la tecnica originale di Peterson, abbiamo eseguito artrotomia di preparazione del sito di innesto, prelievo di lembo periostale della grandezza della lesione e il successivo trasferimento e fissazione con punti in PDS 6.0; abbiamo sempre sigillato il lembo con colla di fibrina ed introdotto i condrociti
nella tasca periostale, avendo l’accortezza di evitarne lo stravaso in articolazione. Il decorso post-operatorio prevede mobilizzazione completa immediata, se possibile, arto in scarico per 2 mesi per le lesioni condiliche e carico completo dell’arto nelle lesioni rotulee.
Abbiamo effettuato un controllo Rm a 2-6-12-24 mesi e una artroscopia diagnostica a 6 e 12 mesi. Per la valutazione dei risultati
abbiamo utilizzato la scheda ICRS in 4 gradi: nella nostra casistica abbiamo tutti risultati di grado 1,1-2 (normale-quasi normale).
L’obbiettivo di questo lavoro è quello di permettere al lettore di capire la natura e l’evoluzione delle lesioni cartilaginee, di riconoscere
le difficoltà e le controversie della terapia chirurgica tradizionale e dei nuovi metodi sperimentali, per valutare criticamente
gli sviluppi delle terapie atte a riparare le lesioni della cartilagine articolari.
Introduzione
Le lesioni della cartilagine articolare umana sono spesso il risultato di eventi traumatici patogeneticamente non chiari. La loro incidenza può crescere a causa del danno cartilagine-osso durante le attività comuni e gli stress articolari.
La cartilagine articolare adulta ha una capacità di cicatrizzazione molto limitata dopo i traumi acuti e cronici, e così le lesioni della cartilagine non guariscono naturalmente e si instaura spesso una degenerazione progressiva(1). Fino a oggi, il trattamento chirurgico approvato ed efficace è consistito inizialmente nel debridement, perforazioni e microfratture e solo dopo l’insuccesso di queste procedure, la terapia universalmente accettata consiste nel trapianto osteocondrale con tecnica tradizionale e con cilindretti d’osso, o quando le condizioni lo necessitino con una protesizzazione(2-3).
La perfetta cicatrizzazione dei difetti della cartilagine articolare è un problema insoluto. Molti metodi sono stati provati, per accrescere la qualità del tessuto di cicatrizzazione, ma finora, nessuno ha ottenuto dal trattamento, la cartilagine con le proprietà normali, ma, soprattutto il perfetto collegamento tra la zona cicatrizzata e la cartilagine sana circostante resta uno dei problemi ancor oggi insoluti.
In effetti la cicatrizzazione ottimale di una lesione cartilaginea che mostri dei delimitati confini istologici con la cartilagine sana fa pensare ad una area di non completa restitutio ad integrum: il contrario di quello che si vorrebbe dimostrare con le procedure terapeutiche.
Dopo la pubblicazione, da parte di Peterson e Brittberg, nel 1994, dei primi risultati dell’innesto di condrociti (Aci) in pazienti con lesioni traumatiche della cartilagine del ginocchio, la notizia di questa tecnica ha moltiplicato l’interesse per la cura di queste lesioni(4).
Il dilemma della patologia cartilaginea è oggi particolarmente pressante per i chirurghi ortopedici, essendo la nostra una civiltà nella quale l’aumento medio dell’età pone problemi di usura in soggetti ancor troppo giovani per poter essere sottoposti ad interventi chirurgici di protesizzazione articolare.
Il tipo di sollecitazioni alle articolazioni, dovute a traumi da incidenti stradali e/o da sport od a microtraumi legati alla vita di tutti i giorni, determinano un deterioramento della cartilagine ialina che costituisce il pavimento dell’articolazione(5-10).
Il solo prevedibile trattamento efficace, nei casi gravi, per il dolore ed il deficit articolare del ginocchio è la sostituzione cartilaginea nei giovani e la protesi negli anziani: è il caso di lesioni della cartilagine da lesioni traumatiche o da condizioni patologiche, tra le quali ricordiamo l’osteocondrite dissecante (OD) o quelle lesioni, non guarite naturalmente, che approdano ad un quadro di osteoartrosi (OA) e che subiscano progressiva degenerazione. Comunque, in generale, sia i trapianti osteocondrali che le protesi non permettono un uso completo ed il carico illimitato dell’articolazione, come spesso richiesto dai pazienti giovani. Per questo sono stati costantemente cercati trattamenti alternativi. La riparazione dei difetti della cartilagine articolari rappresenta ancora un problema insoluto. Sono stati provati molti metodi e materiali per migliorare la qualità del tessuto di cicatrizzazione, ma finora nessun metodo ha ottenuto la cartilagine ialina, normale per proprietà biomeccaniche, e soprattutto un perfetto collegamento con la cartilagine ialina circostante la lesione.
Dopo la pubblicazione dei primi risultati del trapianto di condrociti in pazienti con lesione cartilaginea localizzata nel ginocchio del lavoro di Peterson e Brittberg, si è sviluppato un nuovo grande interesse per questo vecchia metodica chirurgica modificata e resa attuale dalla tecnica sofisticata di differenziazione cellulare.
Le ricerche sulle lesioni traumatiche della cartilagine sono state meno costanti rispetto al miglioramento continuo operato nella ricerca di trattamento della patologia del menisco e dei legamenti, specialmente se si considera la loro frequenza nei soggetti giovani.
Durante questi traumi, si altera l’equilibrio di compenso delle forze di taglio con la separazione della cartilagine nella sua composizione tra gli strati superficiali e profondi: ciò determina una differente qualità di lesione cartilaginea che potrà evolvere in maniera assai diversa(10-18).
La classificazione delle lesioni della cartilagine
Le lesioni della cartilagine possono passare misconosciute sia quando di superficie, non penetranti fino all'osso, ma anche quando profonde, con l’esposizione dell’osso. Frequentemente le lesioni cartilaginee provocano una sintomatologia dolorosa importante che determina la necessità di un trattamento, che sarà rapportato non alla sintomatologia ma al quadro anatomo-patologico. Riteniamo dunque importante classificare, per il trattamento, il grado di lesione cartilaginea, considerando che spesso la cartilagine guarisce spontaneamente(18-24).
Molti protocolli sperimentali su animali, hanno dimostrato l'assenza di risposta spontanea cellulare a lesione indotta meccanicamente. Non sono stati riscontrati i caratteristici meccanismi di guarigione, quali il coagulo di fibrina o la migrazione e l'aderenza cellulare. Tale situazione non migliora neppure a distanza di tempo. Anzi gli aspetti istomorfologici delle lesioni indotte sperimentalmente possono essere paragonati alle lesioni tipiche dei primi stadi della osteoartrosi(19-24).
Le lesioni profonde vanno frequentemente incontro ad una cicatrizzazione fisiologica riproducibile sperimentalmente.
La cartilagine di cicatrizzazione entra nella lesione e tenta di riempirla come coagulo di fibrina. Entro 2-5 giorni, le cellule mesenchimali invadono il grumo della fibrina, e comincia la differenziazione in condrociti: le lesioni della cartilagine alla fine sono piene di tessuto di riparazione.
Per 8 settimane, il tessuto ha molte somiglianze con la cartilagine ialina, ma la struttura del tessuto cicatriziale mostra forti analogie per la cartilagine fibrosa.
Dopo 3 mesi, i segni della degradazione tessutale sono sempre più visibili, e dopo 6-12 mesi la cartilagine di riparazione è ridotta ad una superficie irregolare ed erosa. Inoltre, la zona di collegamento tra la zona in via di cicatrizzazione e la matrice della cartilagine originale, è irregolare e l'area di interfaccia ha un contenuto in proteoglicani diminuito, riflettendo la sempre accresciuta quantità di condrociti in fase catabolica(24-29).
In definitiva, le caratteristiche del tessuto di riparazione della cartilagine sono quelle di un tessuto fibroso che è lungi dalla struttura funzionale della cartilagine ialina.
Il risultato degli studi sperimentali sulle lesioni cartilaginee profonde, può essere paragonato al quadro degenerativo cronico che si ritrova nell’osteoartrosi o nell’osteocondrite dissecante, dopo la rimozione del bottone osteocondrale o dopo trattamento con perforazioni(30,31).
I concetti terapeutici
sperimentali per il trattamento delle lesioni condrali
Il lavoro di Brittberg ed altri del 1994 ha avuto il merito di rendere noto a tutti i clinici del mondo il metodo dell'isolamento della cellula cartilaginea, la cultura successiva ed il trapianto in lesioni condrali, ma ha anche fatto diventare popolare questa terapia non sempre di grande soddisfazione per i ricercatori, i medici, ed il pubblico dei pazienti. Il concetto terapeutico è basato sugli esperimenti che avevano dimostrato che i condrociti giovani (condroblasti) trapiantati in difetti condrali, prolificando e trasformandosi in cellule mature possono riempire il difetto. Sono stati fatti molti esperimenti su animali, in particolare, dai conigli immaturi o adolescenti cellule mesenchimali abbiamo isolato e coltivato per diversi giorni e, dopo la sintesi della matrice cartilaginea, furono trapiantato in difetti condrali creati sperimentalmente degli stessi conigli(32-40).
Gli animali furono uccisi in tempi diversi dal trapianto, ed esaminate le lesioni riparate. I risultati di queste analisi furono che il tessuto di guarigione cartilaginea fu considerato per essere ialino-uguale, anche se la parte periferica della lesione era caratterizzata da tessuto con caratteristiche non proprio paragonabili alla cartilagine ialina, ma piuttosto a cartilagine fibrosa. Questo fa supporre che esista un insufficente od addirittura assente collegamento tra il tessuto di cicatrizzazione e la cartilagine ialina circostante. Nel contrasto, il tessuto trapiantato aderiva costantemente all’osso subcondrale profondo.
Un problema del trapianto dei condrociti è lo sviluppo di un numero sufficiente di cellule. Perciò si sono sviluppate molte tecniche di cultura specifica per accrescere la proliferazione delle cellule in vitro prima del trapianto. Per questa ragione, diversi gruppi di ricerca promossero una sospensione dei condrociti isolati in gel tridimensionali, durante il tempo della proliferazione in vitro(41-46).
Il trapianto di condrociti negli esseri umani
Il trapianto di condrociti umani si può considerare una sfida per diverse ragioni, primo per la scarsezza di cellule del sito donatore. Per ovviare a questo problema, Brittberg coltivò le cellule prelevate in un substrato ed ottenne una proliferazione di condrociti. I condrociti coltivati furono iniettati nel difetto condrale. Per impedire la perdita immediata delle cellule iniettate, il difetto condrale fu coperto da un flap di periostio sigillato con colla di fibrina.
I ricercatori sostengono che le cellule iniettate aderiscono immediatamente alla superficie ossea del difetto della cartilagine. Al contrario, Rosenberg ed altri non confermano la capacità di attecchimento immediato dei condrociti nei difetti condrali, in realtà dentro i difetti le cellule crescerebbero dal lembo del periostio suturato sul difetto o dalle cellule dell’osso subcondrale.
Tuttavia, Brittberg ha mostrato i risultati clinici 2 anni dopo il trapianto di condrociti in 23 pazienti con difetti localizzati post-traumatici della cartilagine. Per sedici pazienti i difetti erano ai condili femorali, 7 pazienti avevano profonde lesioni cartilaginee della rotula.
Il risultato ha portato ad un successo della procedura nell’80% dei casi. I preparati delle sezioni del tessuto dalle biopsie di controllo dell’autore mostrarono della cartilagine assolutamente ialina(47-60).
La valutazione degli studi sperimentali su animali e degli studi clinici su pazienti circa la guarigione della cartilagine mostra una variazione larga dei risultati, a volte piuttosto contraddittoria che riflette la difficoltà di questo tipo di ricerca. Una ragione è la mancanza dei procedimenti standardizzati nello sperimentazione animale e la mancanza di uno studio randomizzato a doppio cieco, controllato da placebo o gruppo terapeutico tradizionale. La valutazione delle caratteristiche della ricerca di base ed i controlli dei pazienti nel lavoro di Brittberg è stata fatta su giudizi dei ricercatori negli studi sperimentali e su valutazioni soggettive ed oggettive dei pazienti operati, senza minimamente valutare la possibilità di una guarigione eguale o migliore con trattamento tradizionale. In altre parole, non è dimostrato che la guarigione della cartilagine sia dovuta in massima parte alla sospensione cellulare, al tessuto periostale o addirittura alla guarigione spontanea indotta dalla preparazione della base di impianto come potrebbe succedere nei trattamenti tradizionali come le perforazioni sec. Pridie o le microfratture sec. Stedman. Inoltre, le caratteristiche biomeccaniche del trapiantato della cartilagine non sono state, a tutt’oggi, completamente esaminate, e soprattutto nessuno ha potuto mai dichiarare che questo trattamento comunque possa ritardare l’evoluzione dell’osteoartrosi secondaria a difetto cartilagineo(61,62).
Tuttavia, il voce di Brittberg ha promosso un interesse grande fra i chirurghi ed i pazienti con OA ed altri problemi simili. In parte, questo “successo” è connesso con le strategie della commercializzazione dei trattamenti con condrociti. In questa ottica vanno considerati validi gli studi effettuati da centri non interessati allo sviluppo commerciale della procedura ed in particolare tutti gli studi che prevedano un gruppo di controllo ed un periodo di tempo sufficiente a dimostrare la validità effettiva a distanza della metodica.
Infatti, dopo la fase iniziale dell’entusiasmo grande, i chirurghi ed i pazienti con OA, hanno capito che l’indicazione corretta di questo procedimento è la lesione traumatica piuttosto piccola e localizzata della cartilagine dei condili femorali e della rotula non antecedente i 3 anni(63).
Si deve aspettare il risultato dello studio multicentrico che il gruppo svedese (Brittberg, Peterson ed altri) ha promosso per questa strategia terapeutica nuova del trapianto di condrociti. I pazienti tra le 18 e le 48 anni dell'età sono randomizzati in tre gruppi: Il primo gruppo sarà trattato con le perforazioni di Pridie, il secondo gruppo prevede un trattamento del difetto condrale mediante un flap di periostio ed il terzo gruppo è trattato con autoinnesto autologo di condrociyti dopo la cultura e la proliferazione in laboratorio, iniettato sotto il flap del periostio. Gruppi 2 e 3 è trattato in un doppio cieco.
Le lesioni condrali traumatiche
La capacità di riparazione della cartilagine ialina è limitata dal fatto che è sprovvista di vascolarizzazione e pertanto la risposta infiammatoria al trauma è assente.
Come menzionato sopra, i difetti della cartilagine di superficie che penetrino nello spazio subcondrale non guariscono spontaneamente. Fino a poco tempo fa, la ragione principale per questo comportamento era la consapevolezza che la zona di transizione, difinita di giunzione osteocondrale o tide mark, debba essere intatta per permettere un’accettabile cicatrizzazione cartilaginea. In realtà si è dimostrato che esistono dei controlli umorali del difetto cartilagineo, che impediscono l’adesione e la proliferazione sufficiente a riempire il difetto e che esistono per contro altri fattori di crescita (ormoni, proteine ecc.) che favoriscono la cicatrizzazione. è evidente che l’evoluzione di un trauma a carico della cartilagine articolare con scarsa cicatrizzazione determina a lungo termine fenomeni degenerativi a carico della qualità dell’articolazione che porterà inevitabilmente all’artrosi secondaria.
Molti studi clinici dimostrano una relazione tra lesione cartilaginea non cicatrizzata ed osteoartrosi, in particolare nel 1996, Messner e Gillquist hanno pubblicato i risultati, a 14 anni di distanza, dell’evoluzione naturale di difetti localizzati condrali di superficie localizzati, in 28 pazienti: dopo una valutazione clinica e radiografica, 14 anni più tardi, 16 pazienti erano inclusi nel gruppo con segni di OA.
L'esame artroscopico consente di valutare con una certa accuratezza la sede, il tipo ed il grado di lesione. Talora esso pone in evidenza lesioni condrali isolate di difficile diagnosi.
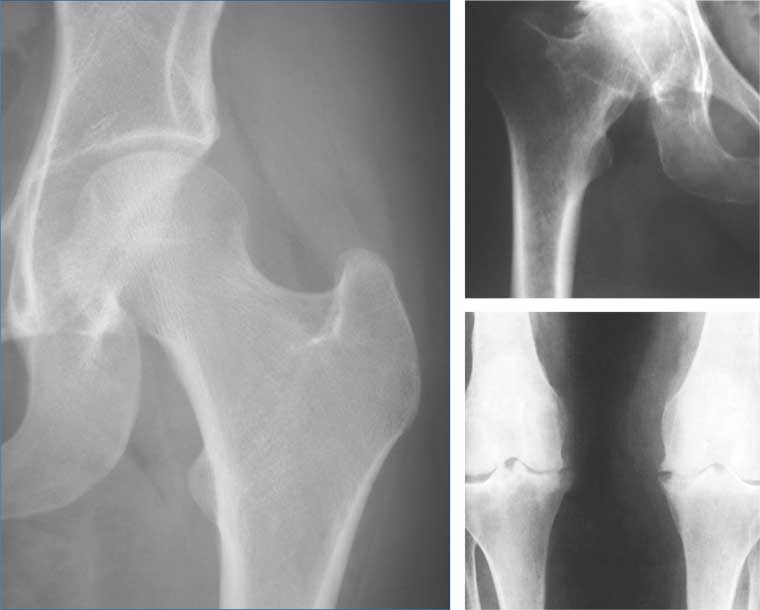
La terapia chirurgica attuale per i difetti condrali
Vogliamo rapidamente descrivere in questo capitolo quali sono le nostre procedure abituali di trattamento chirurgico delle lesioni cartilaginee, anche in considerazione delle indicazioni al trattamento con aci al quale faremo riferimento ampiamente in seguito.
Lesioni condrali: Nei casi di insuccesso delle terapie incruente può rendersi necessario il trattamento chirurgico. Nelle lesioni parziali a “flap” è possibile eseguire la rimozione del frammento condrale ai fini di evitare un impingement meccanico o la formazione di corpi liberi endo-articolari, seguito da una delicata regolarizzazione del focolaio lesionale mediante strumento motorizzato. Recentemente l’utilizzo di laser Hol-YAG) e delle radiofrequenze si è dimostrato efficace a tal scopo.
Le lesioni a tutto spessore possono essere trattate con la rimozione dei frammenti avulsi e la successiva abrasione associata o meno a perforazioni o microfratture dell'osso subcondrale. L'abrasione può essere effettuate con una fresa motorizzata non eccessivamente aggressiva. Le perforazioni, secondo tecnica usuale debbono essere attuate rispettando i concetti della possibile riparazione, quindi non trapani ad alta velocità e punte troppo smusse; la tecnica consigliata è quella che si avvale di fili lanceolati che vengano infissi nello strato osseo mediante battitura, avendo cura di ruotare dolcemente la punta al fine di creare un foro irregolare con matrice ossea non compressa.
La tecnica di Stedman è stata minuziosamente descritta dall’ideatore e si base sul concetto della perpendicolarità terapeutica dei fori provocati nell’osso.
Appare evidente come tutti questi trattamenti siano parte essenziale della routine terapeutica chirurgica, e che, solo in caso di fallimento di dette procedure o nei casi di gravità tale da orientarci ad un trattamento più impegnativo quale i trapianti osteocondrali o gli aci, possono risolvere in prima istanza la problematica dei nostri pazienti.
Lesioni osteocondrali: Il trattamento chirurgico in questi casi dipende da alcuni fattori quali le dimensioni del frammento, la sede del distacco, il tempo trascorso dal trauma e quindi la qualità del frammento.
Quando si approccia una lesione osteocondrale, si deve considerare la sua eziologia: diverso è il programma se si tratti di una osteocondrite dissecante(OD) o di una lesione osteocondrale traumatica.
Nel primo caso il fondo della lesione è sempre sclerotico e mal disposto ad una rivitalizzazione, mentre in presenza di una lesione traumatica, anche non freschissima, lo strato osseo esposto, pur in crisi vascolare presenta caratteristiche di vitalità migliori.
Le dimensioni del frammento in realtà condizionano maggiormente la guarigione dell’aricolazione: secondo logica, infatti più grande è la lesione meno perfetta potrà essere la guarigione. In presenza di frammenti di piccole dimensioni è possibile asportarli.
Se le dimensioni sono tali da consentirlo ed il distacco si è verificato a livello delle superfici di carico è possibile effettuare una reinserzione del frammento.
Esistono diverse tecniche chirurgiche di reinserzione che possono essere effettuate sia a cielo aperto che in artroscopia.
Esse prevedono la sintesi con viti di Herbert, viti cannulate AO o mezzi di sintesi riassorbibili.
Il tempo trascorso dal trauma e la qualità vascolare del bottone osteocondrale debbono essere gli elementi di maggior preoccupazione per il chirurgo: reinserire una pastiglia ossea con scarse possibilità di rigenerazione oppure riinnestarla in un terreno poco disposto ad una improbabile rivitalizzazione, possono essere motivo di insuccesso terapeutico catastrofico: il frammento non vitale manterrà la sua caratteristica di elemento stimolante il dolore, l’impotenza funzionale e il gonfiore articolare.
In questi casi soprattutto, a nostro giudizio trovano efficace applicazione le tecniche terapeutiche più invasive e costose del trattamento della patologia cartilaginea: gli innesti osteocondrali massivi o a fiammifero e l’autoinnesto di condrociti.
Esse vengono utilizzate nei casi di lesioni condrali a tutto spessore, lesioni osteocondrali ed osteocondriti dissecanti a carico della rotula e delle superfici condiliche di carico.
La metodica di trapianto osteocondrale massivo ha costituito per anni la tecnica unica per la terapia di lesioni condrali ed ossee importanti. A nostro parere anche questa tecnica ha avuto un nuovo impulso d’uso perché molti chirurghi sono stati stimolati a cercare di capire le reali diversità di risultato tra le varie tecniche moderne e questa metodica tradizionale
Le tecniche di trapianti multipli ideate da Hangody e Bobic sono universalmente conosciute: la metodica consiste nel prelievo di cilindretti osteocondrali, mediante appositi strumentari, da siti donatori localizzati a livello delle superfici condiliche non sottoposte a carico ed il loro successivo innesto a livello del sito lesionale, previa adeguata preparazione dello stesso.
I cilindretti osteocondrali possono essere di diverse dimensioni in modo da poter riempire in modo sufficientemente preciso la sede della lesione e nel contempo ripristinarne il fisiologico raggio di curvatura. Tale tecnica è eseguibile sia a cielo aperto che in artroscopia.
Concettualmente diversa è la tecnica di autoinnesto di condrociti, applicata sull’uomo da Peterson e coll. dal 1989. Essa consiste nel prelevare in artroscopia una piccola quantità di tessuto cartilagineo dall'articolazione danneggiata ; successivamente, in laboratorio viene avviato un procedimento di digestione enzimatica attraverso cui i condrociti vengono separati dalla matrice extra-cellulare. I condrociti estratti, vengono piastrati ed espansi in vitro fino ad ottenere una concentrazione adeguata che viene posta in terreno di coltura. Il tempo successivo consiste nell'esecuzione di un intervento chirurgico a cielo aperto. Il focolaio lesionale viene preparato e regolarizzato.
Un lembo periostale viene prelevato dalla superficie antero-mediale della tibia omolaterale e viene posto a copertura del difetto, suturandolo con punti staccati. Viene anche utilizzata della colla di fibrina per rendere ermetica la copertura. La sospensione di condrociti viene quindi iniettata all'interno del focolaio mediante un’apposita siringa fino a riempire il difetto.
Il trapianto di condrociti nei difetti condrali traumatici
Può il trapianto di condrociti essere considerato la terapia chirurgica ideale dei difetti condrali in OD e le ferite traumatiche?
Nel 1996, Brittberg e Peterson avevano trattato 251 pazienti con 308 difetti condrali con una combinazione di trapianto di condrociti e tasca di lembo del periostio. Gli AA. riportarono risultati soddisfacenti nell’80% dei pazienti, con un follow-up medio di 3 anni e 11 mesi.
Questi risultati, non pubblicati, furono riportati Meeting Annuale dell'American Academy di Orthopaedic Surgeons nel 1996. Di fronte a queste percentuali, una delle controversie discusse fu l'indicazione per aci. Brittberg propose si quattro indicazioni:
1) lesione traumatica isolata, in zona
di carico del condilo femorale;
2) OD del condilo femorale;
3) le lesioni osteocondrali in pazienti con lesione del legamento anteriore
4) osteomalacia dolorosa della rotula resistente il trattamento conservativo, in assenza di displasia.
|
I chirurghi negli Stati Uniti racco-
mandano il trapianto di condrocite solo dopo fallimento di trattamento tradizionale.
|
In relazione a queste valutazioni generali, nel 1996, abbiamo programmato un trial sperimentale e clinico di valutazione randomizzata dei risultati del trattamento di lesioni cartilaginee traumatiche, creando due progetti di lavoro:
Gruppo condili femorali: vengono aggregati al gruppo soggetti di età variabile tra i 18 e i 45 anni, affetti da lesione traumatica recente dei condili femorali, mai sottoposti a chirurgia precedente. La lesione, in acuto, è stata trattata, con terapia convenzionale, mediante debridement artroscopico. Nella stessa seduta si è effettuato prelievo di frammento cartilagineo sano nella gola intercondiloidea. La cartilagine prelevata viene inviata in laboratorio di differenziazione cellulare dove le cellule vengono manipolate e perfrigerate in attesa dell’auto-innesto.
Solo i pazienti che, secondo i criteri dello studio di Peterson presentano sintomi soggettivi ed oggettivi a distanza di almeno sei mesi dall’evento lesionale, vengono sottoposti a trattamento chirurgico.
Tale trattamento viene deciso per sorteggio preliminare: chirurgia con aci (Gruppo 1), oppure “convenzionale” con trapianto osteocondrale a fiammifero sec. Hangody (Gruppo 2). Il trattamento con aci è stato eseguito con criteri rigorosi assolutamente uguali a quelli descritti da Peterson: chirurgia a cielo aperto, lembo periostale, sigillo con colla di fibrina.
Per la tecnica convenzionale dei cilindri di osso abbiamo rispettato la tecnica originale di Hangody: tecnica artroscopica, fiammiferi osteocondrali di varie dimensioni posizionate a mosaico.
Gruppo rotula: sono stati aggregati a questo gruppo soggetti di età variabile tra i 18 e 45 anni, affetti da lesione traumatica recente delle faccette articolari della rotula, mai sottoposti a terapia chirurgica precedente, in assenza di displasia femoro-rotulea. Come per l’altro gruppo, la lesione è stata trattata mediante debridement artroscopico e è stato effettuato prelievo di un frammento di cartilagine dalla gola intercondiloidea. La cartilagine inviata a laboratorio CBA per la differenziazione. Dopo 6 mesi, i Pazienti ancora sintomatici sono stati avviati, a sorteggio al trattamento chirurgico che è consistito, nel gruppo di studio in trattamento della lesione con lembo periostale e autoinnesto di condrociti sec. la tecnica di Peterson, nel gruppo di controllo nella copertura della lesione con solo lembo periostale, secondo la tecnica di Lorentzon.
Il decorso postoperatorio dei pazienti prevede, per il gruppo condili uno scarico articolare per due mesi e mobilizzazione attiva e passiva immediata, per il gruppo rotula un carico femoro-tibiale immediato e scarico femoro-rotuleo per 2 mesi.
Sono stati programmati controlli clinici mensili, nel protocollo è stato previsto controllo Rm a 2-6-12-24 mesi e controllo artroscopico, in accordo con il paziente, a 6 e 12 mesi.
Tale studio è iniziato nel 1997, si conclude nel 2001 ed è in progetto pubblicarne i risultati nel 2002.
Conclusioni
Dovendo concludere questo capitolo sul trattamento della patologia cartilaginea traumatica, riteniamo che le strategie attuali della terapia chirurgica prevedono correttamente un trattamento poco invasivo, in fase acuta, della lesione cartilaginea: l’obbiettivo resta sempre quello di mantenere i presupposti biologici di guarigione spontanea della cartilagine.
Solo nei casi in cui il quadro clinico post-lesionale resti sintomatico, si potrà accedere ad un trattamento chirurgico più impegnativo quale il trapianto osteocondrale o la metodica aci.
Queste regole, generalmente accettate, per la ricostruzione della normalità anatomica sono valide nella esperienza clinica attuale, in apparenza non esistono differenze sostanziali di risultato a medio termine tra le diverse metodiche terapeutiche della cartilagine. Quello che incide maggiormente nel meccanismo di guarigione sono i fattori di variabilità della lesione e della qualità di rigenerazione delle cellule; esiste poi il problema della integrazione del tessuto neoformato con il tessuto circostante, dove spesso si formano delle zone di non perfetta cicatrizzazione con possibile persistere di minore resistenza.
Si deve fare poi una considerazione della reale efficacia a lungo termine della terapia chirurgica della cartilagine.
Non esiste ancor oggi una distinzione di risultati a lungo termine tra i procedimenti terapeutici attuali ed in prospettiva, di una possibile evoluzione migliorativa della struttura articolare. In altri termini, si può oggi affermare che esista oggi un trattamento chirurgico che eviti una evoluzione più o meno rapida della lesione cartilaginea in osteoartrosi?
Tutti gli studi sulle terapie chirurgiche attuali parlano di un sostanziale miglioramento della funzione articolare, di una riduzione espressiva del dolore, di una qualità di vita riacquistata.
Mancano però degli studi a lungo termine dei risultati dopo le perforazioni di Pridie o le microfratture o il debridement che dimostrino che questi trattamenti, oltre a dare vantaggio a proposito del dolore, dell'indebolimento e dell'incapacità funzionale riducano o ritardino lo sviluppo di OA.
Indubbiamente c’è grande aspettativa degli effetti a lungo termine dell’innesto cartilagineo anche alla luce delle continue esperienze cliniche e di laboratorio. Lo sviluppo di nuove culture e di nuove applicazioni porteranno ad una standardizzazione e semplificazione delle procedure e garantiranno una maggiore omogeneità dei risultati. Ma alla base di una certezza terapeutica sarà ancora necessaria una valutazione a lungo termine.
Naturalmente questi dati andranno considerati in maniera rigorosa a maggiore distanza dall’intervento, ma la nostra esperienza appare molto positiva e meritevole di ulteriore verifica. ■
Bibliografia
1. Ghadially FN, Thornas 1, Oryschak AF, et al. Long term results of superficial defects in articular cartilage: A scanning electron microscope study.
J Pathol 1977; 121:213‑7.
2. Háuselmann H.J., Healing enhancement with chondrocyte transplantation and other means Sports Med. and Arthr. Rev. 6:50‑59.1998 Lipp-Raven, Phil.
3. Bruns J, Liissenhop S, Lefunann L. Osteochondritis dissecans patellaeErgebnisse der operativen tierapie. Z Orthop 1996; 134:7‑10. (German)
4. Brittberg M, Lindahl A, Nilsson A, Ohlsson C, lsaksson 0, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med 1994;331:879‑95.
5. Brittberg M, LindahI A, Homminga G, Nilsson A, Isaksson 0, Peterson L. A critical analysis of cartilage repair. Acta Orthop Scand 1997;68:186‑91.
6. Aichroth P. Osteochondral fractures and their relationship to osteochondritis dissecans of the knee B.J.S.(Br.) 1971;53B:448‑54.
7. Aichroth P. Osteochondrifis dissecans of the knee. J Bone Joint Surg [Br] 1971;53B:440‑7.
8. Enneking WF. Clinical Musculoskeletal Pathology. Gamesville, FL: Storter Printing; 1977.
9. Funke E, Munzinger U, Marty M, Drobny T. Operative Langzeitresultate der Osteochondrosis dissecans des Kniegelenkes bei Jugendlichen unter 16 Jahren. Z Unfallchir Vers Med 1994;87:178‑85. (German)
10. Sontag LW, Pyle SL Variations in the calcification pattems in epiphyses. Am J Roentgenol 194 1;45:50.
11. Petrie PWR. Aetiology of osteochondritis dissecans. J Bone Joint Surg [Br] 1977;59B:366‑7.
12. Siffert RS. The osteochondroses. Clin Orthop 198 1; 158:2‑3.
13. Siffert RS. Classification of the osteochondroses. Clin Orthop 1981;158:10‑8.
14. Messner K, Maletius W. The long‑term prognosis for severe damage to weight‑bearing cartilage in the knee: A 14‑year clinical and radiographie follow‑up in 28 young athletes. Acta Orthop Scand 1996;67:165‑8.15. Levy AS, Lolmes J, Sculley S, LeCroy M, Garrett W. Chondral delamination of the knee in soccer players. Am J Sports Med 1996;24:634‑9.
16. Linden B. Osteochondritis dissecans of the femoral condyle. A longterm follow‑up study. J Bone Joint Surg [Amj 1977;59A:769‑76.
17. Kuettner KE, Schleyerbach R, Peyron JG, Hascall VC. Articular Cartilage and Osteoarthritis New York: Raven Press; 1992.
18. Buckwalter JA, Lohmander S. Operative treatment of osteoarthrosis‑current practice and future development. J Bone Joint Surg [AmI 1994;76A: 1405‑18.
19. Bullough PG. The pathology of osteoarthritis. In: Moskowitz RW (Ed.) Osteoarthritis. Diagnosis and Medical Surgical Management. Philadelphia: W13 Saunders; 1992;39‑70.
20. Howell DS. Pathogenesis of osteoarthritis. Am J Med 1986;80:24‑8.
21. Hunziker EB. Articular cartilage structure in humans and experimental animals. In: Kuettner KE, Schleyerbach R, Peyron JG, Hascall VC (Eds.) Articular Cartilage and Osteoarthritis. New York: Raven Press; 1992; 183‑99.
22. Schiller AL. Pathology of osteoarthritis. In: Kuettner KE, Goldberg VM (Eds.) Osteoarthritic Disorders. Rosemont, IL: American Academy of Orthopaedic Surgeons; 1995;95‑101.
23. Mankin HJ. Localization of tritiated thymidine in articular cartilage of rabbits. I. Growth in immature cartilage. J Bone Joint Surg 1962;44:682‑8.
24. Mankin IIL The reaction of articular cartitage to injury and osteoarthritis. N Engl J Med 1974;291: 1285‑92.
25. Shapiro F, Koide S, Glimcher MI. Cell origin and differentiation in the repair of full‑thickrìess defects of articular cartilage. J Bone Joint Surg [Amj 1993; 75A:532‑53.
26. Altman RD, Kates J, Chun LE, Dean DD, Eyre D. Preliminary observations of chondral abrasion in a canine model. Ann Rhewn Dis 1992;51:1056‑62.
27. Mitcheli N, Shepard N. The resurfacing of adult rabbit articular cartilage by multiple perforations through the subchondral bone. J Bone Joint Surg [AmI 1976;58:230‑3.
28. Childers JCJ, Ellwood SC. Partial chondrectomy and subchondral bone drilling for chondromalacia. Clin Orthop 1979; 144:114‑20.
29. Insall J. The Pridie debridement operation for osteoarthritis of the knee. Clin Orthop 1974;32B:302‑6.
30. Green WT, Banks HH. Osteochondritis dissecans in children. Clin Orthop 1990;255:3‑12.
31. Bruns J, Klima H. Osteochondrosis dissecans genus. Z Orthop 1993; 131:413‑9.
32. Chesterman PJ, Smith AU. Homotransplantation of articular cartilage and isolated chondrocytes.
J Bone Joint Surg [Br] 1968;50B: 184‑97.
33. Green WT. Articular cartilage repair: Behavior of rabbit chondrocytes during tissue culture and subsequent allografting. Clin Orthop 1977;124:237‑50.
34. Bentley G, Greer RB. Homotransplantation of isolated epiphyseal and articular chondrocytes into joint surfaces. Nature 197 1;230:385‑8.
35. Itai S, Abramovici A, Nevo Z. Use of cultured embryonal chick epiphyseal chondrocytes as grafts for defects in chick articular cartilage. Clin Orthop 1987;220:284‑303.
36. Brittberg M, Faxen E, Peterson L. Carbon fiber scaffolds in the treatment of early knee osteoarthritis‑a prospective 4‑year follow up of 37 patients. Clin Orthop 1994;307:155‑64.
37. Brittberg M, Nilsson A, Lindahl A, Offisson C, Peterson L. Rabbit articular cartilage defects treated with autologous cultured chondrocytes. Clin Orthop 1996;326:270‑83.
38. Kandel RA, Chen H, Clark J, Renlund R. Transplantation of cartilaginous tissue generated in vitro into articular joint defects. Artif Cells Blood Substit Immobiol Biotechnol 1995;23:565‑77.
39. Grande DA, Singh IJ, Pugh J. Healing of experimentally produced lesions in articular cartilage following chondrocyte transplantation. Anat Rec 1987; 218:142‑8.
40. Freed LE, Marquis JC, Nohria A, Emmanual J, Mikos AG, Langer R. Neocartilage formation in vitro and in vivo using cells cultured on synthetic biodegradable polymers. J Biomed Mater Res 1993;27:11‑23.
41. Wakitani S, Goto T, Pineda SJ, et al. Mesenchymal cell‑based repair of large, full‑thickness defects of articular cartilage. J Bone Joint Surg (Am) 1994;76A:579‑92.
42. Goldberg VM, Caplan Al. Cellular repair of articular cartilage. In: Kuettner KE, Goldberg VM, eds. Osteoarthritic Disorders. Rosemont, IL: American Academy of Orthopaedic Surgeons; 1994;357‑63.
43. Metsáranta M, KujaJa UM, Pelliniemi L, Oesterman H, Aho H, Vuorio E. Evidence for insufficient chondrocytic differentiation during repair of full‑thickness defects of articular cartilage. Matrix Biol 1996; 15:39‑47.
44. Wakitani S, Kimura T, Hirooka A, et al. Repair of rabbit articular surfaces with allograft chondrocytes embedded in collagen gel. J Bone Joint Surg [Br] 1989;7 113:74‑80.
45. Homminga GN, Buma P, Koot HW, van der Kraan PM, van den Berg WB. Chondrocyte behavior in fibrin glue in vitro. Acta Orthop Scand 1993;64:441‑5.
46. Hendrickson DA, Nixon AJ, Grande DA, et al. Chondrocyte‑fibrin maffix transplants for resurfacing extensive articular cartilage defects. J Orthop Res 1994; 12:485‑97.
47. Háuselmann HJ, Aydelotte MB, Schumacher BL, Kuettner KE, Gitelis SH, Thonar EJ‑MA. Synthesis and turnover of proteoglycans by human and bovine articular chondrocytes cultured in alginate beads. Matrix 1992; 12:116‑29.
48. Háuselmann HJ, Femandes RJ, Mok SS, Schmid TM, Block JA, Aydelotte MB. Phenotypic stability of bovine articular chondrocytes after long‑term culture in alginate beads. J Cell Sei 1994; 107:17‑27.
49. Paige KT, Cima LG, Yaremchuk MI, Vacanti JP, Vacanti CA. Injectable cartilage. Plast Reconstr Surg 1995;96:1390‑400.
50. Ben‑Yishay A, Grande DA, Menche DS, Pitman MI. Repair of articular cartilage defects using collagen‑chondrocyte allografts. Trans Orthop Res Soc 1992; 17:174.
51. Toolan 13C, Frenkel SR, Pachence JM, Yalowitz L, Alexander H. Effects of growth‑factor‑enhanced culture on a chondrocyte‑collagen implant for cartilage repair. J Biomed Mater Res 1996;31:273‑80.
52. Hunziker EB, Schenk RK. A differential treatment protocol for inducing cartilage and bone repair in full‑thickness articular cartilage defects. Trans Orthop Res Soc 1995;20:170.
53. Sittinger M, Bujia J, Minuth WW, Hammer C, Burmester GR. Engineering of cartilage tissue using bioresorbable polymer carriers in perfusion culture. Biomaterials 1994; 15:451‑6.
54. Vacanti CA, Kim W, Schloo B, Upton J, Vacanti JP. Joint resurfacing with cartilage grown in situ from cell‑polymer structures. Am J Sports Med 1994;22:485‑8.
55. Chu CR, Coutts RD, Yoshioka M, Harwood FL, Monosov AZ, Amiel D. Articular cartilage repair using allogenic perichondrocyte‑seeded biodegradable porous polylactic acid (PLA): A tissue‑engineering study. J Biomed Mater Res 1995;29:1147‑54.
56. Buckwalter JA, Rosenberg LC, Coutts RD, Hunziker EB, Reddi AG, Mow V. Articular cartilage: lnjury and repair. In: Woo SL, Buck‑walter JA (Eds.) Articular Cartilage Injury and Repair of the Musculoskeletal Soft Tissues. Park Ridge, IL: Arnerican Academy of Orthopaedic Surgeons; 1987;465‑82.
57. Messner K. Durability of artificial implants for repair of osteochondral defects of the medial femoral condy1e in rabbits. Biomaterials 1994; 15:657‑64.
58. Messner K, GilIquist J. Synthetic impiants for the repair of osteochondral defects of the medial femoral condy1e‑a biomechanical and histological evaluation in the rabbit knee. Biomaterials 1993; 14:513‑21.
59. Kang R, Marui T, Ghivizzani SC, et al. Ex vivo gene transfer to chondrocytes in full‑thickness articular cartilage defects: A feasibility study. Osteoarthritis Cartilage 1997;5:139‑43.
60. Messner K, GilIquist J. Cartilage repair. A critical review. Acta Orthop Scand 1996;67:523‑29.
61. Háusettnann FU, Masuda K, Hunziker EB, et al. Adult human articular chondrocytes cultured in alginate gel form a matrix similar to native human articular cartilage. Am J Physiol (Cell Physiol) 1996;271:742‑52.
62. Browner BD. What's new in orthopaedie surgery. J Am Colt Surgeons 1997; 184:169‑76.
63. Mankin HJ. Chondrocyte transplantation‑one answer to an 01d question. N Engl J Med 1994; 331:940‑1. |