Immunoflogosi e cronobiologia del processo
infiammatorio. Un nuovo approccio farmacologico
in traumatologia sportiva
C. Massullo
Specialista in Medicina dello Sport
Introduzione
Se fino agli anni '70 il processo infiammatorio è stato studiato soprattutto nella sua valenza patologica, indagandone primariamente i meccanismi biochimici ed intervenendo terapeuticamente attraverso il blocco dei fenomeni chimici e vasali dello stesso, e negli anni '80-'90 l'infiammazione è stata interpretata come fenomeno principalmente immunitario, il nuovo millennio ci ha permesso di conoscere i più intimi meccanismi neuro-immuno-endocrini che regolano l'innesco, lo sviluppo e la risoluzione dei complessi processi dell'immunoflogosi.
Parallalelamente una nuova farmacologia si è sviluppata ed ha contribuito all'intima comprensione di questi meccanismi e di come sia possibile agire su di essi nel rispetto della biologia del processo infiammatorio e nella tutela della salute del paziente.
Si tratta di un nuovo paradigma farmacologico che fa riferimento alla Low Dose Medicine, all'utilizzo cioè di bassi dosaggi, in particolare di principi naturali e molecole biologiche, come citochine, neuropetidi, ormoni e fattori di crescita.
Negli ultimi anni, la ricerca di base ha definitivamente fatto comprendere il meccanismo d'azione dei bassi dosaggi e, nel contempo, la ricerca clinica ha suffragato la validità di questo innovativo approccio farmacologico alla patologia infiammatoria con l'evidenza dei risultati derivanti da studi controllati.
In questo articolo viene descritto il meccanismo d'azione di Arnica comp. –Heel, capostipite della famiglia dei farmaci biologici low dose, e viene proposta un'overview dei più importanti studi clinici controllati in ambito orto-traumatologico.
Keywords: immunoflogosi, bio-regolazione, cronobiologia, bassi dosaggi, assenza di effetti collaterali, no-doping.
Epidemiologia delle lesioni muscolo-scheletriche
La mancanza di un criterio diagnostico universalmente accettato per molte delle affezioni a carico dei tessuti molli rende l'epidemiologia di queste malattie difficile da definire. Sebbene la precisa incidenza e prevalenza di ciascun disturbo siano difficili da stabilire, è noto come tali problematiche siano tra le più comuni cause di assenza dal lavoro per malattia(1).
Infatti, le affezioni a carico dei tessuti molli rappresentano il motivo del 59% delle prime visite dal medico specialista e del 15% delle consultazioni presso il medico di famiglia(2).
In Medicina dello Sport, ancor più che in altre branche specialistiche, la gestione sanitaria dei processi infiammatori e degenerativi a carico dei tessuti dell'Apparato muscolo-scheletrico rappresenta una delle principali fonti di consulto medico e si impone per la sua particolare complessità secondaria a numerose variabili: necessità di una rapida risoluzione della patologia infiammatoria, necessità di tempi di recupero rapidi, ricorso a farmaci non inclusi nelle liste della WADA (World Anti Doping Agency), rispetto della salute dell'atleta. L'ampio arsenale di farmaci di sintesi antinfiammatori non soddisfa purtroppo le variabili sopraelencate o per le meno non tutte insieme.
Trattamenti farmacologici convenzionali dell'infiammazione
Un'appropriata gestione della lesione acuta muscolo-scheletrica richiede una pronta valutazione, l'identificazione delle cause e il trattamento di ogni specifica patologia(1).
Il paradigma convenzionale consiste nel controllare il dolore per procedere alla riabilitazione, che deve essere individualizzata e può includere esercizi progressivi per promuovere la flessibilità, la propriocezione, la forza, la velocità, l'agilità e la stabilità. è da tenere presente che molte delle cure per lesioni muscolo-scheletriche sono state sviluppate sulla base dell'esperienza clinica ma con scarsa evidenza nella ricerca scientifica(3).
Farmaci antinfiammatori non steroidei
I farmaci antinfiammatori non steroidei (FANS o NSAIDs) possono essere molto efficaci per il loro effetto analgesico e consentono di anticipare l'inizio della riabilitazione dalle lesioni muscolo-scheletriche acute(4). I FANS inibiscono le ciclossigenasi e quindi riducono il dolore e l'infiammazione. Nel tratto gastrointestinale essi, inibendo l'attività della COX-1, riducono le prostaglandine e incrementano il rischio di effetti collaterali (pericolosi eventi emorragici(5)). I FANS mostrano effetti collaterali dose–dipendenti, che possono limitarne l'uso nei pazienti anziani o nei pazienti ad elevato rischio. Altri effetti collaterali implicano disfunzioni renali e l'inibizione dell'adesione delle piastrine.
Gli inibitori selettivi della COX-2 riducono l'incidenza di tossicità gastrointestinale ma incrementano i costi della terapia e il rischio cardiovascolare, limitandone molto l'impiego in pazienti anziani e in pazienti ad elevato rischio.
è nota l'inibizione dell'aggregazione dei neutrofili e della migrazione verso i siti dell'infiammazione(6). I FANS inoltre alterano la funzionalità dei neutrofili in altro modo rallentando il rilascio degli enzimi lisosomiali, riducendo la fosforilazione ossidativa, riducendo le sostanze chemiotattiche per altri leucociti.
Nonostante i FANS siano comunemente utilizzati nel trattamento delle lesioni acute dei tessuti molli, ad oggi la loro efficacia non è sostanziata nella letteratura scientifica: infatti ci sono indizi che i benefici a breve termine dei FANS siano controbilanciati da una compromissione a lungo termine della struttura e delle funzioni dei tessuti lesi(7).
L'uso dei FANS altera alcuni processi fondamentali coinvolti nella guarigione dei tessuti lesi. Per esempio studi sperimentali hanno documentato l'effetto negativo dei FANS sulla guarigione del tessuto osteo-articolare(7).
Corticosteroidi
Corticosteroidi locali vengono usualmente impiegati per ridurre l'infiammazione nelle tendinopatie croniche, mentre non trovano impiego nella gestione delle lesioni acute (1,2). La terapia infiltrativa con corticosteroidi è uno dei trattamenti più comunemente utilizzati per le lesioni croniche dei tendini (2). Nonostante questo sia un approccio consueto, l'evidenza del beneficio è carente e sono noti i potenziali effetti avversi. è riconosciuto che molte delle raccomandazioni per l'uso infiltrativo di corticosteroidi locali siano basate su aneddotica e non c'è buona evidenza a supporto del loro uso (2).
Qualora vengano impiegati per trattare le tendinopatie i corticosteroidi possono inibire la formazione di aderenze ma anche la granulazione e la formazione del tessuto connettivo, possono ridurre la massa tendinea, l'integrità biomeccanica e la resistenza (2). Gli effetti biomeccanici dei corticosteroidi iniettati in regione peritendinea sui tendini umani non sono stati chiariti, ma sono comuni i casi riferiti di rottura dei tendini a seguito di iniezioni di corticosteroidi (2).
La sepsi è riportata in 1 caso su 17 trattati con iniezioni intrarticolari o nei tessuti molli (2). Altri comuni effetti collaterali includono l'atrofia dei tessuti, reazioni cutanee al volto, reazioni cutanee localizzate nella sede dell'iniezione e reazioni da ipersensibilità.
Una nuova interpretazione del processo infiammatorio ed una nuova farmacologia
Dopo una lesione acuta, l'infiammazione rappresenta la risposta biologicamente opportuna adottata dall'organismo per limitare il danno tissutale e per proteggersi nei confronti di ulteriori insulti (7).
La lesione dei tessuti molli ha come risultato una risposta fisiologica non-specifica che attiva una serie precisa e definita di eventi pro-infiammatori (Tabella 1).
L'area della lesione primaria è definita dall'estensione dell'ematoma iniziale, mentre un maggiore danno cellulare può essere causato dall'edema e dall'ipossia tissutale come conseguenza della risposta vascolare infiammatoria acuta (prima fase vasocostrittiva). Dopo l'iniziale risposta infiammatoria (solitamente entro le prime 24-72 ore), il processo infiammatorio diviene processo di guarigione (7). I tessuti lesi sono ripuliti ad opera dei macrofagi e inizia il processo ricostruttivo (restitutio ad integrum).
Mentre la fagocitosi è in fase di completamento (normalmente dopo alcuni giorni), ha inizio la fase di proliferazione riparatoria: i fibroblasti e i granulociti vengono richiamati per chemiotassi al sito della lesione dai fattori di crescita e nuovo collagene viene prodotto per ricostituire il tessuto leso.
Nel contempo una nuova rete capillare inizia a formarsi per assicurare che il tessuto di granulazione sia ben vascolarizzato(7).
Mentre nuovo tessuto si forma, l'originale tessuto di granulazione si riduce e inizia il processo di maturazione della cicatrice (che in alcuni casi può richiedere sino ad un anno).

Arnica comp.-Heel®:
un approccio differente alla bio-regolazione dell'immunoflogosi
Ripercorrendo l'evoluzione dell'approccio medico al processo flogistico si evidenzia come inizialmente tale processo sia stato studiato soprattutto nella sua valenza patologica, indagandone primariamente i meccanismi biochimici ed intervenendo terapeuticamente attraverso il blocco dei fenomeni chimici e vasali dello stesso.
Successivamente l'infiammazione è stata interpretata come fenomeno principalmente immunitario, mentre nella prima decade del nuovo millennio gli studi pubblicati hanno permesso di conoscere i più intimi meccanismi neuro-immuno-endocrini che regolano l'innesco, lo sviluppo e la risoluzione dei complessi processi dell'immunoflogosi.
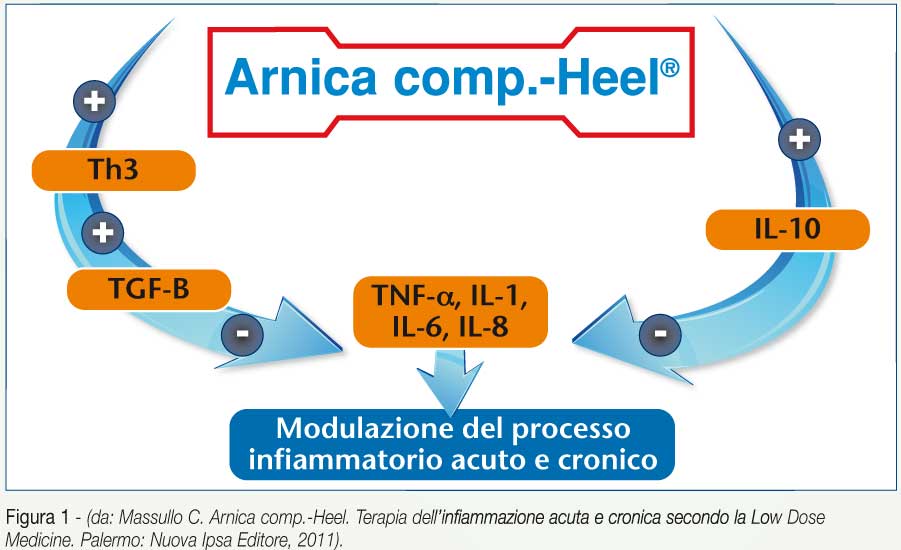
Uno dei punti cardine di questo nuovo approccio al processo infiammatorio identifica nell'induzione della sintesi del Transforming Growth Factor-beta (TGF-β), che promuove la rigenerazione della matrice connettivale e la modulazione del processo flogistico, il principale turning point.(1)
Dall'incontro delle più recenti acquisizioni nell'ambito della Biologia Molecolare con gli ultimi trend della farmacologia dei bassi dosaggi emerge una nuova prospettiva per il trattamento delle lesioni acute muscolo-scheletriche: la valorizzazione della fisiologica capacità di riparazione della lesione sembra la più appropriata strategia per migliorare il risultato terapeutico.
Il medicinale Arnica comp.-Heel, capofila dei farmaci anti-infiammatori biologici low dose stimola la produzione di TGF-β(8) e gli studi clinici dimostrano come ciò implichi benefici effetti sia sul controllo della sintomatologia acuta sia sull'avvio del processo di guarigione (9).
Ma Arnica comp. –Heel non agisce solo sul TGF-β; oggi sappiamo del ruolo giocato dalle sottopopolazioni linfocitarie sull'intero processo infiammatorio e di come esse, per il tramite delle citochine, guidino le fasi dell'infiammazione. Agire su questi intimi meccanismi bio-regolatori, alla base della conservazione o ripristino dell'omeostasi, rappresenta la nuova frontiera della farmacologia antinfiammatoria.
Esistono evidenze scientifiche che Arnica comp.-Heel inibisca direttamente in colture cellulari in vitro, attivate con sostanze proinfiammatorie (fitoemoagglutinina, forbolo miristato acetato, Tumor Necrosis Factor-α), la sintesi delle citochine pro-infiammatorie TNF-α, Interleuchina-1β e Interleuchina-8(10), inoltre, in vivo, il medicinale avvia il processo immunologico (9) (Bystander suppression(11)) che consiste nell'attivazione di cloni di linfociti Th3 (o T-reg), i quali sintetizzano e liberano TGF-β, citochina (fattore di crescita) con forte potere antinfiammatorio. Il TGF-β modula il processo infiammatorio acuto e cronico, tramite l'inibizione delle citochine pro-infiammatorie.
Nel contempo Arnica comp.-Heel, sempre secondo lo stesso meccanismo immunologico, induce in alcune popolazioni di cellule immunocompetenti la sintesi di Interleuchina-10, a valenza antinfiammatoria e contribuisce quindi alla modulazione del processo infiammatorio sia acuto che, soprattutto cronico (Figura 1).
Essa è infatti in grado di modulare la sintesi di citochine pro-infiammatorie (IFN-γ, IL-2, IL-3, TNF-α, GM-CSF) prodotte da macrofagi e linfociti Th1 e ha inoltre mostrato un ruolo importante nel controllo della capacità di presentazione dell'antigene da parte delle APC.
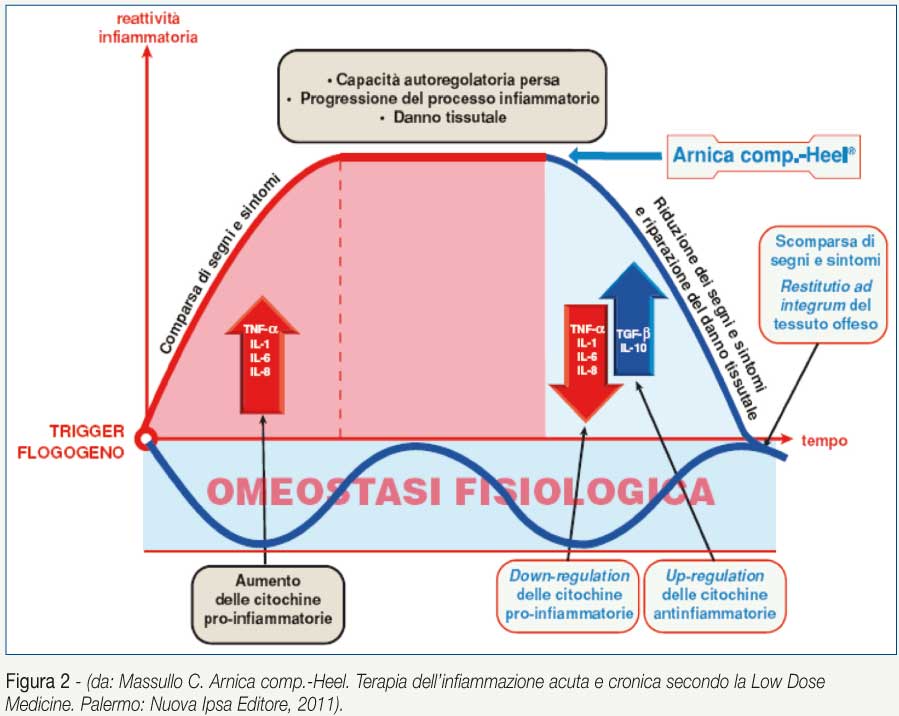
In sintesi Arnica comp.-Heel accelera la risoluzione dell'infiammazione agendo tanto sulla prima quanto sulla seconda fase del processo flogistico.
Agisce infatti sulla prima fase dell'infiammazione, che normalmente si sviluppa nelle prime ore, modulando l'azione delle citochine pro-infiammatorie, con un efficace controllo della sintomatologia e della possibile espansione del fenomeno infiammatorio attraverso la up-reguation delle citochine opponenti antinfiammatorie.
È interessante notare come Arnica comp.-Heel non blocchi queste citochine (fondamentali messaggeri d'innesco del processo difensivo infiammatorio) ma ne normalizzi, con un meccanismo di down-regulation, la concentrazione e la conseguente attività biologica.
Agisce anche sulla seconda fase dell'infiammazione, incrementando la sintesi delle citochine antinfiammatorie che caratterizzano, nella cronobiologia dell'infiammazione, il momento in cui l'immunoflogosi deve essere modulata e ad essa debbano subentrare i processi riparativi. In tal senso TGF-β stimola le funzioni dei fibroblasti (la sintesi di fibronectina e di collagene) e inibisce le metalloproteasi (Figura 2).
Le evidenze – Overview sulla ricerca di base e clinica
Una ricca letteratura riguardante sia la ricerca di base, condotta tramite studi sperimentali in vitro e sul modello animale, sia la ricerca clinica, condotta mediante studi clinici controllati e monitoraggi post-marketing, evidenzia l'efficacia di Arnica comp. –Heel nella modulazione dell'immunoflogosi e nella gestione della sintomatologia infiammatoria a carico dei tessuti dell'Apparato muscolo-scheletrico.
Ricerca di base Effetto antinfiammatorio
su modello animale di infiammazione acuta e cronica
In un lavoro scientifico condotto in vitro è stato testato l'effetto di Arnica comp.-Heel su due importanti funzioni cellulari: la produzione di anione superossido e l'adesione delle piastrine umane.
Accanto al lavoro in vitro è stato anche testato, tramite un modello animale, l'effetto di Arnica comp.-Heel nell'infiammazione cronica (artrite adiuvante indotta nel ratto) e nell'infiammazione acuta (edema plantare da carragenina nel ratto).
Arnica comp.-Heel ha dimostrato di non interferire con la produzione di anione superossido e con l'adesione delle piastrine, dimostrando che l'effetto antinfiammatorio non è attribuibile all'inibizione delle funzioni dei granulociti e/o delle piastrine, su cui esercitano la loro azione taluni noti farmaci antinfiammatori e analgesici.
Arnica comp.-Heel inoltre inibisce lo sviluppo dell'edema locale nell'artrite adiuvante indotta nel ratto (modello di infiammazione cronica) e riduce del 15% l'edema plantare da carragenina nel ratto (modello di infiammazione acuta).
Quest'ultimo risultato è del tutto analogo a quello che si ottiene somministrando una dose di acido acetilsalicilico pari a 30mg/kg nel medesimo modello sperimentale.
I risultati dimostrano che Arnica comp.-Heel ha effetto antinfiammatorio non attribuibile all'inibizione delle funzioni di una specifica linea cellulare o ad un meccanismo biochimico analogo a quello dei farmaci FANS.
Arnica comp.-Heel modula il processo antinfiammatorio a livello locale e non esercita azione inibitoria sui granulociti, prima difesa antimicrobica (Conforti A., Bertani S., Chirumbolo S., Bellavite P., Metelmann H. Experimental studies on the antiinflammatory activity of a homeopathic preparation. Biomedical Therapy. 1997; XV (1): 28-31).
Artrite reumatoide
In uno studio clinico è stata valutata l'efficacia di Arnica comp.-Heel negli stadi iniziali (stadio I e II) dell'artrite reumatoide. Sono stati arruolati 10 pazienti affetti da artrite reumatoide (9 allo stadio I e 1 allo stadio II), ai quali, prima di avviare la terapia con Arnica comp.-Heel, è stata sospesa la somministrazione di tutti i medicinali precedentemente assunti.
La terapia con Arnica comp.-Heel gocce è stata protratta per 14 giorni consecutivi. Prima e dopo la terapia è stata valutata la consistenza del pool dei linfociti Th3, responsabili della sintesi di TGF-β (Transforming Growth Factor-β).
I Th3 svolgono un ruolo fondamentale nei meccanismi biochimici della tolleranza immunitaria, attraverso la liberazione di TGF-β e di IL-10, che esercitano un efficace controllo dell'immunoflogosi. I risultati dimostrano che l'utilizzo di Arnica comp. –Heel incrementa sensibilmente il pool di cellule Th3 (Heine H., Andrä F. The antiinflammatory action mechanism of an antihomotoxic combination remedy. Ärztezeitschrift Naturheilverfahren. 2002; 43 (2): 96-104).
Inibizione delle citochine proinfiammatorie
In uno studio condotto in vitro si è dimostrato l'effetto di Arnica comp.-Heel su linfociti T (isolati da sangue fresco o della linea cellulare T Jurkat CD4+), monociti (linea cellulare THP-1) e cellule dell'epitelio intestinale (linea cellulare HT-29).
La verifica è stata effettuata sulle cellule in condizioni di riposo oppure attivate con PHA (fitoemoagglutinina), PMA (forbolo miristato acetato) e TNF-α (Tumor Necrosis Factor-α). È stata misurata la secrezione delle citochine pro-infiammatorie IL-1β (Interleuchina-1 β), TNF-α, IL-8 (Interleuchina-8) dopo 24, 48 e 72 ore di incubazione. Arnica comp.-Heel ha inibito la secrezione delle tre citochine pro-infiammatorie sia nelle cellule in condizioni di riposo sia nelle cellule attivate (P<0,01 per tutte le cellule):
• la secrezione di IL-1β è diminuita fino al 70%, sia nelle cellule a riposo che nelle cellule attivate;
• la secrezione di TNF-α si è ridotta fino al 65% nelle cellule in condizioni di riposo e fino al 54% nelle cellule attivate;
• la secrezione di IL-8 si è ridotta di oltre il 50% sia nelle cellule a riposo sia nelle cellule attivate.
|
Inoltre si è dimostrato che Arnica comp.-Heel non interferisce con la proliferazione dei linfociti T e dei monociti. I risultati ottenuti in questo studio in vitro hanno contribuito a chiarire il meccanismo alla base dell'effetto antinfiammatorio di Arnica comp.-Heel (Porozov S., Cahlon L., Weiser M., Branski D., Lider O., Oberbaum M. Inhibition of IL-1β and TNF-α secretion from resting and activated human immunocytes by the homeopathic medication Traumeel S. Clinical & Developmental Immunology. 2004; 11 (2): 143-149).
Ricerca clinica
Distorsioni e contusioni negli atleti
In uno studio condotto in doppio cieco, randomizzato, controllato vs placebo si è dimostrata l'efficacia di Arnica comp.-Heel pomata nelle distorsioni e contusioni di I e II grado negli atleti. Sono stati sottoposti a terapia 102 pazienti: 34 con Arnica comp.-Heel, 34 con pomata fitoterapica e 34 con placebo. La dose somministrata è stata: 10-12 g di pomata per 2 volte al dì, riposo e crioterapia. Il trattamento è stato protratto in media per 15 giorni. Sono stati misurati: l'edema, la temperatura cutanea, l'indice del dolore, la massima forza muscolare esprimibile dall'arto, il tempo trascorso prima della ripresa degli allenamenti. È stata condotta una valutazione complessiva dell'efficacia (sia da parte dei pazienti, sia da parte dei medici).
Arnica comp.-Heel pomata è risultata più efficace del placebo ed ha ridotto sensibilmente l'indice del dolore, mentre non si sono osservate significative differenze per la temperatura cutanea nei tre gruppi trattati. Arnica comp.-Heel ha, inoltre, ridotto in modo significativo la circonferenza dell'area interessata. Infine ha permesso un recupero più rapido della forza muscolare e, quindi, una ripresa più rapida degli allenamenti. Arnica comp.-Heel è stata tollerata molto bene (la valutazione dei pazienti e dei medici è stata da buona a ottima). Al 15° giorno si è registrato un valore di P <0,001 per l'indice del dolore e per la valutazione complessiva. (Böhmer D., Ambrus P. Behandlung von Sportverletzungen mit Traumeel- Salbe-Kontrollierte Doppelblindstudie. Biol. Med. 1992; 21 (4): 260-268).
Emartro post-traumatico del ginocchio
In uno studio versus placebo è stata verificata l'efficacia delle iniezioni peri- ed intra-articolari di Arnica comp.-Heel nel trattamento dell'emartro post-traumatico del ginocchio.
Sono stati trattati 73 pazienti (M > 60%, età media 36 anni): 36 con Arnica comp.-Heel, 37 con placebo. Il periodo di osservazione si è protratto per 36 giorni. è stata somministrata un'iniezione intrarticolare di Arnica comp.-Heel o di soluzione fisiologica al 1°, al 4° e all'8° giorno di trattamento. Dopo la prima iniezione solo il 13,5% dei pazienti trattati con Arnica comp.-Heel ha necessitato dell'artrocentesi, mentre nel gruppo placebo la percentuale è stata del 25%. All'8° giorno di trattamento il versamento ematico persisteva nel 5,4% dei pazienti trattati con Arnica comp.-Heel, mentre nel gruppo placebo la percentuale era del 19,4%.
La mobilità articolare nel gruppo Arnica comp.-Heel è aumentata del 78,4%, mentre nel gruppo placebo è aumentata solo del 38,9%. La differenza della circonferenza tra l'articolazione lesa e quella sana è passata da una media di 2,02 cm ad una media di 0,54 cm nel gruppo Arnica comp.-Heel, da 2,18 cm a 1,06 cm nel gruppo placebo. Con Arnica comp.-Heel si è registrata una sensibile riduzione del dolore e non sono state registrate reazioni avverse (Thiel W., Borho B. Die Therapie von frischen, traumatischen Blutergussen der kniegelenke (Hamartros) mit Traumeel N Injectionslosung. Biol. Med. 1991; 20: 506-515).
Trattamento sintomatico della tendinopatia acuta
In uno studio osservazionale non randomizzato è stata dimostrata la non inferiorità di Arnica comp.-Heel pomata versus Diclofenac gel 1% nel trattamento di pazienti affetti da tendinopatie di varia eziologia (da sovraccarico o infiammatorie). Sono stati trattati 319 pazienti divisi in 2 gruppi: gruppo Arnica comp.-Heel (122 pazienti: 63 M, 59 F; età compresa tra 18 e 93 anni) e gruppo Diclofenac (197 pazienti: 108 M, 89 F; età compresa tra 19 e 91 anni). La maggior parte dei casi presentava tendinopatie del gomito, del polso, della caviglia e della spalla. Il trattamento è stato protratto per un massimo di 28 giorni. Sono stati valutati: l'efficacia, la tollerabilità e la compliance. Dai risultati si conclude che Arnica comp.-Heel pomata è un'efficace alternativa alle pomate o ai gel a base di antinfiammatori non steroidei nella terapia dei sintomi acuti dei pazienti affetti da tendinopatia (Schneider C., Klein P., Stolt P., Oberbaum M. A homeopathic ointment preparation compared with 1% diclofenac gel for acute symptomatic treatment of tendinopathy. Explore. 2005; 1 (6): 446-452).
Distorsioni dell'articolazionetibio-tarsica
In uno studio in doppio cieco, randomizzato condotto su 2 gruppi per un totale di 69 pazienti è stata verificata l'efficacia di Arnica comp.-Heel pomata nel trattamento delle distorsioni dell'articolazione tibio-tarsica, riportate durante l'attività sportiva. Sono stati trattati 69 pazienti suddivisi in un gruppo Arnica comp.-Heel, costituito da 33 pazienti (25 M, 8 F, età media 23 anni), e un gruppo placebo, costituito da 36 pazienti (25 M, 11 F, età media 22 anni). Tutti i pazienti sono stati sottoposti ad elettroterapia ad interferenza (Variodyn) associata ad Arnica comp.-Heel oppure placebo.
Il trattamento ambulatoriale è stato ripetuto 7 volte nell'arco di 15 giorni.
Nel gruppo trattato con Arnica comp.-Heel il miglioramento al 10° giorno dopo il trauma è stato significativamente più alto (P = 0,03) rispetto al gruppo trattato con placebo. I criteri di valutazione significativi sono stati: l'ampiezza dell'angolo di flessione sommata a quella dell'angolo di estensione, l'ampiezza dell'angolo di supinazione e la stima del dolore al movimento. Il trattamento è stato considerato positivo se la differenza tra l'angolo totale dell'articolazione lesa e quello dell'articolazione sana si è ridotto di 10 gradi al 10° giorno. I risultati dimostrano la maggiore efficacia di Arnica comp.-Heel rispetto al placebo (Zell J., Connert W.D., Mau J., Feuerstake G. Behandlung von akuten Sprunggelenksdistorsionen. Fortschr. Med. 1988;106: 96–100).
Epicondilite
In uno studio, osservazionale non randomizzato, è stata verificata l'efficacia di Arnica comp.-Heel fiale versus FANS nel trattamento sintomatico dell'epicondilite.
Sono stati trattati 184 pazienti suddivisi in due gruppi: gruppo Arnica comp.-Heel (106 pazienti, età media 49 anni) e gruppo FANS (78 pazienti, età media 46 anni). Lo studio si è protratto per due settimane.
Sono stati valutati il dolore (dolore alla pressione, al movimento e a riposo) e la mobilità articolare (mobilità articolare all'estensione e alla torsione).
Arnica comp.-Heel fiale si è dimostrato equivalente ai FANS nella riduzione della sintomatologia e nei tempi necessari per il raggiungimento dell'effetto terapeutico e superiore ad essi considerando il dolore a riposo (P < 0,01), la mobilità articolare alla torsione (P < 0,01) e la mobilità articolare all'estensione (P < 0,05).
I pazienti hanno valutato il risultato globale ottimo o buono nel 71% dei casi trattati con Arnica comp.-Heel, mentre solo nel 44,2% dei casi trattati con i FANS. Arnica comp.-Heel fiale è stato considerato significativamente meglio tollerato (per l'87,7% dei pazienti la tollerabilità di Arnica comp.-Heel è ottima) dei FANS (per il 44,9% dei pazienti la tollerabilità dei FANS è ottima).
I 3 eventi avversi registrati durante lo studio si sono verificati dopo somministrazione di FANS (Birnesser H., Oberbaum M., Klein P., Weiser M. The homeopathic preparation Traumeel S compared with NSAIDs for symptomatic treatment of epicondylitis. Journal of Muscoloskeletal Research. 2004; 8 (2-3): 119-128).
Traumi e lesioni dell'apparato muscolo-scheletrico
In un lavoro scientifico è stata verificata l'efficacia e la sicurezza d'uso di Arnica comp.-Heel nel trattamento di traumi e lesioni dell'Apparato muscolo-scheletrico (le diagnosi più frequenti sono state le lesioni acute di caviglia, ginocchio e mano), rispetto alle terapie convenzionali (analgesici, antireumatici, anticoagulanti, antinfiammatori).
Sono stati trattati 133 pazienti suddivisi in due gruppi: gruppo Arnica comp.-Heel (69 pazienti: 39 M, 30 F; età media 33 anni) e gruppo terapie convenzionali (64 pazienti: 31 M, 33 F; età media 32 anni).
Arnica comp.- Heel è stato somministrato in un'unica forma farmaceutica (compresse o pomata) nel 67% dei pazienti trattati; nel 33% sono state associate entrambe le forme farmaceutiche. Le terapie convenzionali sono state somministrate in monoterapia (analgesico o antireumatico) nel 69% dei pazienti e come combinazione di più prodotti nel 31% dei pazienti.
Il 59,4% dei pazienti trattati con Arnica comp.-Heel e il 57,8% dei pazienti trattati con terapie convenzionali hanno ottenuto la completa remissione dei sintomi principali al termine del trattamento.
Non si sono registrati effetti avversi nel gruppo Arnica comp.-Heel, mentre nel gruppo con terapia convenzionale si sono registrati 6 eventi avversi (6,3%). La tollerabilità è significativamente migliore con Arnica comp.-Heel (P=0,001). I risultati dimostrano che l'efficacia di Arnica comp.-Heel è equivalente a quella delle comuni terapie convenzionali nel trattamento dei traumi e delle lesioni di moderata o media gravità e che Arnica comp.-Heel è medicinale sicuro e meglio tollerato rispetto ai medicinali convenzionali. (Schneider C., Schneider B., Hanisch J., van Haselen R. The role of a homoeopathic preparation compared with conventional therapy in the treatment of injuries: an observational cohort study. Complementary Therapies in Medicine. 2008; 16(1): 22-27).
Studi sulla safety
In uno studio è stata verificata la sicurezza clinica di Arnica comp.-Heel compresse, attraverso la misurazione dei parametri ematici ed ematochimici prima e dopo il trattamento con il medicinale.
Lo studio, durato 4 settimane, è stato effettuato su un gruppo di 20 volontari sani. Parametri di valutazione: anamnesi, esame ispettivo, analisi delle urine, parametri ematici, parametri ematochimici.
Ai volontari sono state somministrate
2 compresse sublinguali/die di Arnica comp.-Heel. Gli esami di laboratorio sono stati eseguiti una volta alla settimana.
A tutti i soggetti inclusi è stato richiesto di registrare su di un diario giornaliero l'assunzione del farmaco e tutti gli eventuali effetti collaterali negativi. Alla IV settimana è stata effettuata la valutazione di tutti i soggetti inclusi nello studio. La valutazione statistica dei dati non ha rivelato differenze significative (P>0.05) tra prima e dopo il trattamento. Tutti gli effetti collaterali negativi sono stati di lieve entità e temporanei. I disturbi riferiti dai soggetti inclusi sono stati prevalentemente: cefalea, diarrea, vertigini, nausea, insonnia e dolori agli arti (tutti di lievissima entità).
Arnica comp.-Heel è ben tollerato e sicuro. Non è emersa alcuna tossicità gastrointestinale significativa.
Arnica comp.-Heel presenta marcata attività anti-infiammatoria ed analgesica senza inibire il metabolismo dell'acido arachidonico, né la sintesi delle prostaglandine: può essere considerato come una valida e sicura alternativa per i pazienti ad alto rischio di sanguinamento gastrointestinale secondario ad assunzione di FANS (Arora S., Harris T., Scherer C. Clinical safety of a homeopathic preparation. Biomedical Therapy. 2000; XVIII (2): 222-225).
Key points
Arnica comp.-Heel è un efficace trattamento nelle lesioni e infiammazioni acute dell'Apparato muscolo-scheletrico.
Riduce rapidamente l'infiammazione, allevia il dolore e promuove i processi rigenerativi secondari a lesioni di varia origine o da intervento chirurgico. Arnica comp.-Heel viene impiegato per favorire il recupero funzionale in seguito a distorsioni, distrazioni e strappi muscolari, contusioni, nevralgie, edemi, dolore post-chirurgico e per promuovere ed accelerare la guarigione delle ferite. Arnica comp.-Heel è ampiamente impiegato nell'ambito della Medicina Sportiva: infatti non è incluso nella lista dei medicinali banditi dalla World Anti-Doping Agency (WADA)(12).
In Germania, è incluso nella lista dei prodotti raccomandati dal National Anti-Doping Agency (NADA) (13). Per queste ragioni e per la sua efficacia in Traumatologia Sportiva, Arnica comp.-Heel è ampiamente usato nel trattamento delle lesioni e delle infiammazioni muscolo-scheletriche acute degli atleti professionisti. ■
Bibliografia
1 Speed C, Hazleman B, Dalton S. Fast Facts: Soft Tissue Disorders. Second edition. Oxford: Health Press Limited, 2006.
2 Speed CA. Corticosteroid injections in tendon lesions. BMJ. 2001;323(7309):382-386.
3 MacAuley D, Best TM. Reducing risk of injury due to exercise. Stretching before exercise
does not help. BMJ. 2002; 325(7362):451-452 Orchard JW, Best TM, Mueller-Wohlfahrt H-W, et al. The early management of muscle strains in the elite athlete: best practice in a world with a limited evidence basis. Br J Sports Med. 2008;42(3):158-159
4 Hackney RG. ABC of sports medicine. Nature, prevention, and management of injury in sport. BMJ. 1994;308(6940): 1356-1359
5 Sullivan WJ, Panagos A, Foye PM, Sable AW, Irwin RW, Zuhosky JP. Industrial medicine and acute musculoskeletal rehabilitation. 2. Medications for the treatment of acute musculoskeletal pain. Arch Phys Med Rehabil. 2007;88(3 Suppl 1):S10-S13
6 Hertel J. The role of non steroidal anti-inflammatory drugs in the treatment of acute soft tissue injuries. J Athletic Training. 1997; 32(4):350-358
7 O'Connor JP, Lysz T. Celecoxib, NSAIDs and
the skeleton. Drugs Today. (Barc.) 2008; 44(9): 693-709
8 Heine H, Schmolz M. Induction of the immunological bystander reaction by plant extracts. Biomed Ther. 1998;XVI(3):224-226. Heine H, Andrä F. Zum antiinflammatorischen Wirkmechanismus eines Antihomotoxikum compositum [The anti-inflammatory action mechanism
of an antihomotoxic composita remedy]. Ärztezeitschrift für Naturheilverfahren. 2002;43(2):96-104
9 Lussignoli S, Bertani S, Metelmann H, Bellavite P, Conforti A. Effect of Traumeel® S, a homeopathic formulation, on bloodinduced inflammation in rats. Complement Ther Med. 1999; 7(4):225-230
10 Porozov S., Cahlon L., Weiser M., Branski D., Lider O., Oberbaum M. Inhibition of IL-1β and TNF-α secretion from resting and activated human immunocytes by the homeopathic medication Traumeel S. Clinical & Developmental Immunology. 2004; 11 (2): 143-149
11 Weiner HL et al. Induction and characterizion of TGF-β secreting cells. FASEB Journal. 1996; 10 (6): A 1444. Weiner L, Mayer L. Oral Tolerance: Mechanism and Applications. Ann NY Acad Sci. 1996; 78: 1-418
|
|